24/03/2025
Resultado test radiológico
Rev Hosp Clín Univ Chile 2025; 36: 246 - 50. DOI: 10.5354/2735-7996.2025.82250
Gonzalo Miranda G., José de Grazia K., Alejandro Vergara G.
Las imágenes sin contraste muestran una extensa ocupación por contenido hemático del espacio subaracnoideo, comprometiendo las cisternas de la base, cisternas peritroncales, valles silvianos y algunos surcos frontales y parietales bilaterales. Además, se observa sangre en el aspecto declive de los cuernos occipitales de los ventrículos laterales y en el cuarto ventrículo. Las imágenes angiográficas en reformación MIP post administración de medio de contraste demuestran la presencia de un aneurisma sacular en el origen de la arteria comunicante posterior derecha.
El diagnóstico corresponde a una extensa hemorragia subaracnoidea (Fisher IV) y hemoventrículo secundario a la rotura de un aneurisma de la arteria comunicante posterior derecha.
DISCUSIÓN
En ausencia de traumatismo, la instauración brusca de síntomas neurológicos focales debe considerarse de origen vascular (ictus o accidente cerebrovascular) hasta que se demuestre lo contrario. Para el diagnóstico resulta crucial la realización de estudios de imagen que permitan distinguir entre un infarto isquémico, hemorragia intracraneal (HIC) y otras causas(1).
Alrededor del 80% de todos los ictus se debe a isquemia - infarto y alrededor de un 15% corresponden a hemorragia cerebral primaria (HTA y angiopatía amiloidea)(1). Dentro de las otras etiologías de ictus encontramos la hemorragia subaracnoidea (HSA) no traumática, oclusiones venosas, vasculitis y otras causas menos frecuentes. La HSA no traumática corresponde al 3-5% de todos los ictus y el 80% de estos se debe a la rotura de un aneurisma sacular intracraneal. Los aneurismas intracraneales están presentes en un 1-2% de la población(2).
La hemorragia en el espacio subaracnoideo es limitada y focal. La sangre extravasada se mezcla con el líquido cefalorraquídeo (LCR) para luego diseminarse de forma difusa a través de las cisternas y surcos. En ocasiones, la sangre refluye hacia los ventrículos cerebrales, produciendo una hemorragia intraventricular(1).
Los pacientes con HSA no traumática presentan, por lo general, una cefalea grave de instauración brusca o “en trueno”. Otras manifestaciones incluyen confusión, dolor cervical, déficit neurológico o compromiso de conciencia(3).
Hallazgos en exámenes de imágenes(1,3):
∙ La HSA no traumática se distingue con facilidad del hematoma parenquimatoso por su localización y configuración. La sangre de los espacios subaracnoideos, al llenar las cisternas y los surcos superficiales, adopta una apariencia curvilínea o serpenteante. Se adapta a la forma de la superficie cerebral y casi nunca produce expansión/compresión focal(1).
∙ La sangre es hiperdensa en las imágenes de tomografía computada. La TC de cerebro sin medio de contraste presenta una sensibilidad cercana al 100% durante los tres primeros días siguientes al sangrado, declinando al 50% a los 5-7 días(3).
∙ En resonancia magnética, el LCR sanguinolento aparece “sucio” en secuencia ponderada en T1, ya que la sangre es isointensa con el parénquima cerebral en fase aguda; hiperintenso en secuencia T2 FLAIR y muestra artefacto de “blooming” en secuencias T2* y de susceptibilidad (SWI)(1).
Se reconocen tres patrones principales de HSA no traumática: HSA aneurismática, HSA perimesencefálica no aneurismática y HSA de la convexidad.
HSA ANEURISMÁTICA
Los aneurismas intracraneales más frecuentes son los aneurismas saculares y son lesiones adquiridas que nacen en los puntos de ramificación de las arterias cerebrales principales, donde la tensión hemodinámica es máxima (Figura 1). Más del 90% se ubican en la circulación anterior o carotídea: 1/3 en la arteria comunicante anterior (ACoA), 1/3 en la unión de la arteria carótida interna (ACI) y la arteria comunicante posterior (ACoP) y un 20% en la bifurcación/trifurcación de la arteria cerebral media (ACM). El 10% restante se desarrolla en la circulación posterior o vertebrobasilar, principalmente en la bifurcación de la arteria basilar y en la arteria cerebelosa posteroinferior (PICA)(1).
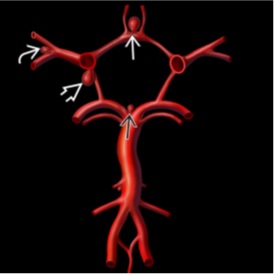
ACoA (flecha blanca). Bifurcación de la ACM (flecha curva). Unión de la ACI y la ACoP (flecha abierta). Bifurcación de la basilar (flecha negra).
Como la mayoría de los aneurismas intracraneales surgen del polígono de Willis y de la bifurcación de la arteria cerebral media, la HSA aneurismática tiende a extenderse por las cisternas de la base y hacia las cisuras de Silvio.
La sangre extravasada por la rotura de un aneurisma cerebral puede, por su elevada presión, disecar y lacerar el parénquima. Hasta en un 20% de los pacientes con HSA aneurismática se observa simultáneamente un hematoma parenquimatoso. En ocasiones, el componente subaracnoideo puede ser mínimo, predominando el parenquimatoso. La localización del hematoma se relaciona con la del aneurisma responsable, siendo las más típicas las regiones frontobasales mediales y el lóbulo temporal(4).
Las principales opciones de tratamiento incluyen el clipaje quirúrgico y el tratamiento endovascular (embolización con coils)(3).
HSA PERIMESENCEFÁLICA NO ANEURISMÁTICA
La sangre se localiza alrededor del mesencéfalo (cisterna interpeduncular y cisterna ambiens) y anterior a la protuberancia(1).
Este tipo de HSA es autolimitado, rara vez determina vasoespasmo y probablemente sea secundario a hemorragia venosa(1).
HSA DE LA CONVEXIDAD
Corresponde a la presencia de sangre en uno o varios surcos superiores de los hemisferios cerebrales(1).
Este tipo de HSA se asocia a diversas causas, como trombosis de venas corticales, angiopatía amiloide, vasculitis y el síndrome de vasoconstricción cerebral reversible(1).
El vasoespasmo cerebral sintomático es una complicación importante de la HSA aneurismática(1,3) que ocurre en un 20-40% de los pacientes. La isquemia e infartos cerebrales tardíos que pueden generarse representan la causa más frecuente de morbimortalidad entre los pacientes que sobreviven a la hemorragia inicial.
La escala de Fisher modificada es un método radiológico de graduación de la HSA aneurismática evaluada en la primera TC sin contraste. Su utilidad radica en predecir el riesgo de vasoespasmo sintomático y, por lo tanto, de morbimortalidad. El riesgo de vasoespasmo es de aproximadamente 23% para las HSA grado I; 33%, para los grados II y III; y 40%, para las de grado IV(4).
La angiografía por sustracción digital (DSA) es considerada la técnica de referencia para el diagnóstico. Dentro de los métodos no invasivos utilizados para detectar estadios precoces de vasoespasmo encontramos la ecografía Doppler transcraneal, la angioTC, la TC de perfusión y la resonancia magnética(1).
Algunas de las medidas de prevención más utilizadas incluyen el uso de nimodipino y el drenaje lumbar externo de LCR(3).
Otra complicación que se observa a menudo en los pacientes con HSA aneurismática es la hidrocefalia obstructiva(1,3). Esta puede manifestarse en las primeras horas tras la hemorragia y empeora si hay hemorragia intraventricular. Los estudios de imagen muestran dilatación del sistema ventricular y aumento del líquido extracelular periventricular con borramiento de los márgenes de los ventrículos laterales.
Por último, es importante mencionar que el traumatismo es, por mucho, la causa más común de HSA y puede ser secundaria, tanto a traumatismos directos sobre el cráneo como a traumatismos cerrados indirectos. Rara vez ocurre de forma aislada y se acompaña, por lo general, de otras manifestaciones de lesión cerebral. Se localiza sobre todo en las regiones perisilvianas, la porción basal anterior de surcos temporales y frontales y a nivel de la convexidad cerebral.
RESOLUCIÓN DEL CASO
Durante el día del ingreso se realiza una angiografía cerebral que confirma la presencia de un aneurisma sacular de aspecto multimamelonado, en el origen de la arteria comunicante posterior derecha, el cual se cateteriza de manera selectiva y se procede a embolizar con coils, quedando excluido de la circulación cerebral. La imagen A de la Figura 2 muestra el aneurisma; la imagen B muestra la instalación de los coils al interior del saco aneurismático; la imagen C muestra resultado exitoso de la embolización con coils, con exclusión del aneurisma.

Debido al alto riesgo de vasoespasmo se realizó tratamiento profiláctico con nimodipino e instalación de drenaje espinal. Finalmente, la paciente evoluciona favorablemente, clínica e imagenológicamente, siendo extubada al tercer día de hospitalización, con recuperación progresiva y total del nivel de conciencia. Es dada de alta el día 21 con una parálisis facial izquierda como única secuela, sin otros signos de focalidad neurológica. Las imágenes de TC no contrastada de control al momento del alta (Figura 3) muestran la presencia del ovillo de coils en la región paraselar derecha, sin lesiones parenquimatosas encefálicas secuelares, sin hidrocefalia.

REFERENCIAS
1. Osborn AG. El encéfalo, diagnóstico por imagen, patología y anatomía. Madrid: Editorial Panamericana, 2018.
2. Brown RD Jr, Broderick JP. Unruptured intracranial aneurysms: epidemiology, natural history, management options, and familial screening. Lancet Neurol 2014;133:393-404.
3. Lawton MT, Vates GE. Subarachnoid hemorrhage. N Engl J Med 2017;377:257-66.
4. Frontera JA, Claassen J, Schmidt JM, Wartenberg KE, Temes R, Connolly ES, et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: the modified fisher scale. Neurosurgery 2006;59:21-7.
Ir al test.