Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Evaluación electrofisiológica del sistema auditivo y vestibular
The clinical evaluation of hearing loss in adult patients is usually performed by perceptual assessment through audiometer tests. This evaluation requires cooperation of the evaluated subjects. On the other hand, it is not possible to perform a perceptual audiometer test in newborns, and due to the need of an early audiological management of deafness in newborns -with hearing aids or cochlear implants-, modern medicine requires early diagnosis of hearing loss, preferably before the age of three months. Several electrophysiological clinical tools have been developed in audiology that allow us to make early diagnosis of hearing loss in those who are unable to respond an audiometry. The electrophysiological evaluation of the auditory system includes cochlear potentials, auditory brainstem responses, and cortical auditory evoked potentials. On the other hand, the electrophysiological evaluation of the vestibular system includes the cervical and ocular myogenic vestibular potentials (cVEMPs and oVEMPs). This article also includes a brief description of otoacoustic emissions, which are not an electric measure of the central nervous system, but are widely used as a diagnostic tool in pediatric audiology. The physiological advances in the knowledge of the auditory system allowed the early diagnosis of hearing loss in the newborn. However, none of these electrophysiological tests replaces the perceptual evaluation of hearing thresholds with audiometric tests.
Rev Hosp Clín Univ Chile 2016; 17(4):287 - 99.
Diego Olmedo G., Alessandra Chiti-Morales, Héctor Córdova J., Paul H. Delano.
Los estímulos sensoriales que nos rodean son detectados por receptores especializados del sistema nervioso como la retina en los globos oculares, el órgano de Corti en el oído interno o el epitelio olfatorio en la cavidad nasal. En las células de los receptores sensoriales se produce la transducción sensorial de los estímulos, esto es un proceso fisiológico en que por la presencia de un estímulo externo, cambia el potencial eléctrico de la membrana plasmática de la célula receptora. Además existen vías neurales que conectan estos receptores con el cerebro y que conducen potenciales de 288 Revista Hospital Clínico Universidad de Chile acción hacia la corteza cerebral. Finalmente, la corteza cerebral permite a los sujetos construir las experiencias perceptuales, como ver, oír u oler(1-2).
Esta simplificación de la fisiología de los sistemas sensoriales nos permite separar en forma conceptual dos procesos diferentes: (i) respuestas electrofisiológicas del sistema sensorial y (ii) percepción de estímulos. Frente a un paciente que presenta un posible déficit sensorial, como disminución de la agudeza visual o sordera (hipoacusia), en la práctica clínica habitualmente se utiliza un examen que mide umbrales perceptuales, como una audiometría en el caso de la hipoacusia o la prueba de Snellen en la agudeza visual. Es importante destacar que para realizar estos exámenes se necesita de un paciente despierto, capaz de entender órdenes y colaborador. Muchas veces no es posible realizar una evaluación perceptual de un paciente con un probable déficit sensorial. En el caso de la hipoacusia, si nuestro paciente es un recién nacido o un lactante menor a 6 meses, no será capaz de comunicar si escucha o no un estímulo particular. Por otra parte, un paciente con un deterioro cognitivo importante o con compromiso de su nivel de conciencia, tampoco será capaz de responder un examen perceptual como una audiometría. En audiología se han desarrollado una serie de exámenes electrofisiológicos que nos permiten estudiar posibles hipoacusias en los pacientes que por diversas razones no logran responder una audiometría. En las siguientes páginas se revisan los exámenes electrofisiológicos disponibles en la práctica clínica audiológica.
EXÁMENES ELECTROFISIOLÓGICOS QUE PERMITEN ESTUDIAR AL SISTEMA AUDITIVO
La evaluación electrofisiológica del sistema auditivo incluye a los potenciales cocleares, los potenciales evocados de tronco encefálico y los potenciales corticales, tanto evocados como oscilaciones cerebrales inducidas. Además, se incluye a las emisiones otoacústicas, que si bien no corresponden a una respuesta eléctrica del sistema nervioso, sino a una mecánica, son ampliamente utilizadas en la evaluación audiológica (Tabla 1). Es importante destacar que ninguno de estos exámenes reemplaza a la evaluación perceptual de la audición. Así, siempre que sea posible, se debe realizar un examen audiométrico, por ejemplo, al crecer un lactante de más de 6 meses de edad probablemente podrá contestar una audiometría conductual o condicionada por juego o cuando un paciente adulto mejore de un compromiso de conciencia, podrá responder un examen audiométrico(3).
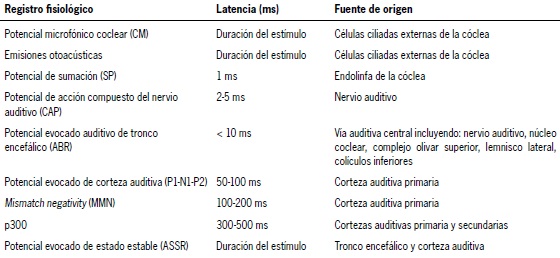
Tabla 1. Potenciales evocados auditivos
ELECTROCOCLEOGRAFÍA
Los potenciales cocleares fueron descubiertos por Wever y Bray en 1930, quienes realizaron experimentos en gatos y registraron las corrientes eléctricas que se generan al colocar un electrodo cerca de la ventana redonda de la cóclea(4). Posteriormente, se ha descubierto que los potenciales cocleares provienen de las células ciliadas de la cóclea y de neuronas del nervio auditivo y que reciben modulación por el sistema eferente auditivo(5-6). A nivel clínico, se utiliza el término de electrococleografía, para referirse al examen que permite medir los potenciales cocleares por medio de un electrodo colocado cerca de la ventana redonda de la cóclea. Específicamente se pueden utilizar técnicas de registro no invasivo, colocando el electrodo de registro en el conducto auditivo externo o en la membrana timpánica, o técnicas de registro invasivo, colocando electrodos transtimpánicos sobre el promontorio o en el nicho de la ventana redonda. Las técnicas noinvasivas permiten registrar potenciales pequeños del orden de los micro-Volts (10-6), mientras que las técnicas invasivas, permiten registros del orden de centenas de micro-Volts o incluso de mili-Volts (10-3)(7). La electrococleografía permite registrar la corriente alterna (extracelular) que se genera en las células ciliadas cocleares en respuesta a un estímulo auditivo. Esta es casi idéntica al estímulo acústico, por lo que se conoce como potencial microfónico coclear (CM), y corresponde al potencial de receptor del órgano de Corti. Existe también una respuesta electrofisiológica de la suma de los potenciales de acción del nervio auditivo, conocida como potencial de acción compuesto del nervio auditivo (CAP). El CAP se obtiene a partir de la sincronización acústica con clics (sonido tipo chasquido de banda ancha) o tonos puros de corta duración (tone bursts), pero también se puede obtener con sincronización eléctrica, como con la estimulación del promontorio de la caja timpánica o a través de un implante coclear (E-CAP). La magnitud del CAP (o E-CAP) se puede medir utilizando la amplitud de N1 o del peak-to-peak N1-P1 y se correlaciona con el número de neuronas del nervio auditivo que fueron reclutadas con el estímulo acústico o eléctrico. Además del CAP y de las CM, se puede medir el potencial eléctrico de sumación (SP), que se considera una medida proveniente de la carga eléctrica de la endolinfa del oído interno(5). En la práctica clínica, la electrococleografía se puede utilizar en el diagnóstico de la neuropatía auditiva, de la enfermedad de Ménière, y en la evaluación de niños candidatos a implante coclear. La neuropatía auditiva se caracteriza por presentar potencial microfónico coclear normal con alteración de la morfología y amplitud del CAP(8). En relación al hidrops endolinfático (enfermedad de Ménière) se produce una alteración de la razón entre la amplitud del SP/CAP con un índice mayor a 0,4; esto sugiere la presencia de un aumento del volumen del líquido endolinfático coclear, concordante con un hidrops endolinfático(9). Finalmente, el E-CAP es ampliamente utilizado en la evaluación electrofisiológica que se realiza al colocar un implante coclear, confirmando la estimulación eléctrica de las neuronas del nervio auditivo(10).
POTENCIALES EVOCADOS AUDITIVOS DE TRONCO ENCEFÁLICO (ABR O BERA)
Desde el descubrimiento del electroencefalograma por Hans Berger en 1924(11) y de que los estímulos auditivos pueden modificar las respuestas eléctricas cerebrales(12), se han desarrollado diversos métodos para registrar la actividad eléctrica del cerebro en respuesta a estímulos acústicos. Los potenciales auditivos de tronco encefálico fueron desarrollados por Jewett y colaboradores en 1970 y 1971. Estos autores descubrieron que al colocar electrodos en la superficie del cuero cabelludo, y estimular con clics, mediante técnicas de promediación de la señal cerebral, es posible obtener ondas estereotipadas con latencias inferiores a 10 milisegundos y que corresponden a la actividad eléctrica generada por los núcleos de la vía auditiva central en el tronco encefálico(13-14). Estas ondas fueron denominadas con números romanos del I al VII, proponiendo que la onda I es análoga a la N1 del CAP y, por lo tanto, que proviene del nervio auditivo. La onda II proviene principalmente del núcleo coclear; la onda III, del complejo olivar superior; la IV, del lemnisco lateral; la V, de los colículos inferiores; la VI, del cuerpo geniculado medial (tálamo auditivo) y la VII, de las fibras tálamo-corticales que van a la corteza auditiva primaria(15,16). En la Figura 1 y 2 se muestran ejemplos de ABRs normal y sugerente de hipoacusia. Es importante destacar que las fuentes generadoras de cada una de las ondas de los ABR pueden ser una mezcla de núcleos del tronco encefálico, por lo que su valor en topo-diagnóstico es limitado y menor al de una técnica anatómica como una resonancia magnética cerebral(17). Los potenciales evocados auditivos de tronco encefálico han sido ampliamente utilizados en el diagnóstico clínico de sordera del recién nacido(18) y en estudios con modelos murinos(19). Actualmente para evocar ABRs se pueden utilizar estímulos de banda ancha como los clics o chirps, o estímulos de frecuencias específicas como los tone bursts (500, 1000, 2000 y 4000 Hz). Más aún, con la utilización de estímulos de polaridad alternante, se puede estudiar el potencial microfónico coclear, y de manera similar a la electrococleografía puede ayudar al diagnóstico de neuropatía auditiva(8,20). Actualmente, se sugiere realizar estudio con ABR a todos los recién nacidos con factores de riesgo para hipoacusia, siendo esta evaluación parte del protocolo de la garantía GES para prematuros o menores de 1.500 gramos vigente en Chile(21-22).
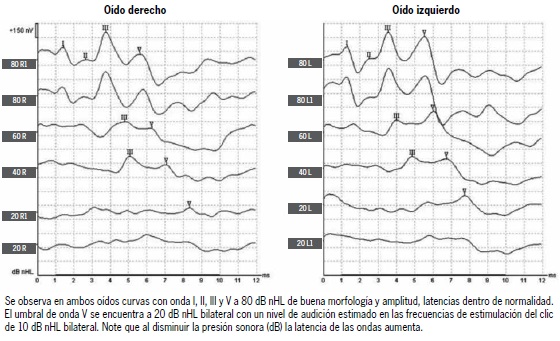
Figura 1. Potenciales evocados auditivos de tronco encefálico normales
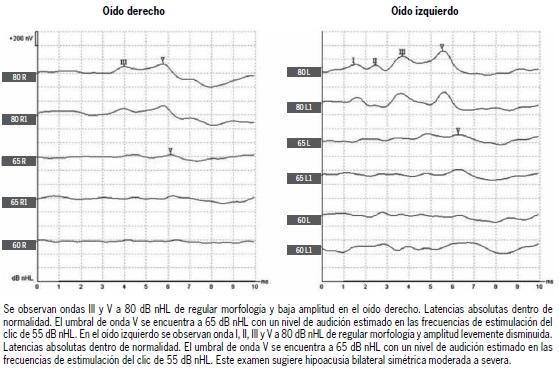
Figura 2. Potenciales evocados auditivos de tronco encefálico anormales
POTENCIALES DE CORTEZA AUDITIVA
Los potenciales de corteza auditiva se pueden clasificar en tempranos o sensoriales y en tardíos o cognitivos. Los potenciales evocados corticales tempranos corresponden al complejo de ondas P1-N1-P2 que se producen alrededor de los 50 a 100 milisegundos(23-24). Estos potenciales miden las respuestas electrofisiológicas de la corteza auditiva primaria y secundaria, pudiendo realizar estudios de umbrales auditivos con estímulos complejos como fonemas(25). Ya que el potencial evocado de corteza puede ser evocado con estímulos tonales de baja frecuencia, de larga duración o con fonemas, es una herramienta que permite evaluar entrenamiento auditivo o el uso de dispositivos auditivos. Por ejemplo, los potenciales evocados de corteza auditiva han sido utilizados para evaluar la efectividad de un tratamiento de entrenamiento audiológico(26) y para evaluar la eficacia del uso de audífonos e implantes cocleares en niños(27). Los potenciales evocados de corteza auditiva tardíos corresponden al potencial de disparidad o Mismatch negativity (MMN) y al p300. El MMN tiene una latencia de 100 a 200 milisegundos y aparece en forma automática frente a la presentación de estímulos auditivos novedosos, que rompen la monotonía de un estímulo presentado en forma regular y constante(28). El MMN se correlaciona con la habilidad perceptual para discriminar la frecuencia de un estímulo como diferente de la frecuencia de otro. Se sugiere que el MMN se generaría en la corteza auditiva primaria(29), aunque existe evidencia de que dependería de las vías descendentes que van de la corteza auditiva primaria a los colículos inferiores(30). Estos potenciales pueden resultar de utilidad en la estimación de la sensibilidad auditiva y también en la evaluación del entrenamiento auditivo(25). Por otra parte, el p300 se obtiene con un paradigma similar al del MMN, pero en este caso el sujeto debe estar despierto y colocar atención al estímulo auditivo novedoso o desviante.
POTENCIALES DE ESTADO ESTABLE (ASSR) Y OSCILACIONES CEREBRALES
Los potenciales cocleares, de tronco encefálico y corticales se obtienen utilizando presentación de repeticiones de estímulos, para luego promediar la señal biológica en el tiempo(31). Este promedio permite visualizar toda la actividad eléctrica sincronizada al estímulo auditivo o a un pulso eléctrico y elimina todo aquello que no está sincronizado. Sin embargo, existe actividad eléctrica cerebral inducida por estímulos auditivos que se pierde utilizando técnicas clásicas de promedios. En 1981 Robert Galambos demostró que las ondas cerebrales se pueden encarrilar a la frecuencia de amplitud modulada de 40 Hz de un estímulo auditivo(32). Por otra parte, un estímulo auditivo simple como un clic, tono o ruido blanco también puede generar actividad cerebral oscilatoria(33). De esta forma las oscilaciones cerebrales encarriladas a una frecuencia de amplitud modulada o potenciales de estado estable (ASSR) y las oscilaciones cerebrales inducidas o no encarriladas, se estudian utilizando técnicas que promedian el espectro frecuencias de una señal, como por ejemplo el análisis de Fourier o wavelets. Los ASSR han sido utilizados para medir respuestas eléctricas cerebrales a distintas frecuencias audibles (ejemplo: 1, 2 y 4 kHz) que son presentadas en diferentes frecuencias de amplitud modulada (ejemplo 71, 86, 93 Hz correspondientemente). Al realizar un análisis frecuencial del electroencefalograma del cerebro del paciente, se buscan en forma dirigida los peaks en las frecuencias de amplitud modulada (en este ejemplo, 71, 86 y 93 Hz). De esta forma, si obtengo valores significativos para las frecuencias de 71 y 86 Hz, pero ausentes en la de 93 Hz, significa que el cerebro respondió a 1 y 2 kHz, pero no a 4 kHz. Teóricamente este método de análisis podría permitir obtener umbrales electrofisiológicos a diferentes frecuencias; sin embargo, la variabilidad interindividual es alta, por lo que no existen valores normativos válidos entre distintas poblaciones(34).
EMISIONES OTOACÚSTICAS
Las emisiones otoacústicas fueron descubiertas por David Kemp en 1978 y corresponden a sonidos generados (energía mecánica medido como presión sonora en dB SPL) por las células ciliadas externas del oído interno(35). Estos sonidos son de muy baja amplitud (de -20 a 20 dB SPL), por lo que no son audibles y se debe utilizar un micrófono de alta sensibilidad para detectarlas. Existen emisiones otoacústicas espontáneas y provocadas por estímulos auditivos. En la práctica clínica se utilizan emisiones otoacústicas provocadas por estímulos tipo clic (denominadas transientes) o por dos estímulos de frecuencia cercana (f1 y f2, con una razón frecuencial de 1,2 a 1,3) que provocan distorsiones cocleares en la frecuencia de 2f1-f2, conocidas como productos de distorsión coclear (DPOAE). Las presencia (al menos 6 dB sobre el nivel de ruido basal) o ausencia de DPOAEs se utiliza actualmente en el tamizaje neonatal de hipoacusia en el recién nacido sin factores de riesgo(36). Un recién nacido que no posee DPOAE tiene mayor riesgo de tener hipoacusia, pero ya que ésta puede ser conductiva o sensorioneural, el examen debe ser repetido y luego ingresa a un protocolo que considera la evaluación electrofisiológica con potenciales evocados auditivos de tronco encefálico.
EVALUACIÓN DEL SISTEMA VESTIBULAR
Muchas veces, además de evaluación de la función auditiva, es necesario realizar una evaluación del sistema vestibular. Clásicamente esta evaluación se realiza mediante la anamnesis y examen físico otoneurológico, y la prueba calórica clásica (VIII par). Sin embargo, en los últimos años han aparecido nuevas tecnologías para la evaluación complementaria del sistema vestibular como la prueba de impulso cefálico con video (vHIT) para evaluar la función de los canales semicirculares y los potenciales evocados miogénicos vestibulares (VEMP), que permiten evaluar la función otolítica (sáculo y utrículo).
POTENCIALES EVOCADOS MIOGÉNICOS VESTIBULARES
Los VEMPs corresponden a un examen electrofisiológico no invasivo que evalúa la función otolítica (utrículo y sáculo) por medio de reflejos vestíbulo- espinales (cVEMP, sáculo) y vestíbulo-ocular (oVEMP, utrículo)(37). Estas respuestas se obtienen promediando la respuesta miogénica de latencia corta evocada por pulsos breves de sonido intensos (conducida por aire en el caso de los cVEMP), o por vibración (conducida por hueso, en el caso de los oVEMP). Ambos exámenes presentan el beneficio de que son no invasivos, y son fáciles y rápidos de realizar, no presentan dolor ni molestias al paciente y se pueden realizar en niños pequeños. Es importante destacar que una limitación de los cVEMPs es que no se pueden aplicar a pacientes con hipoacusia conductiva.
VEMP CERVICALES
Los cVEMPs evalúan el reflejo vestíbulo espinal, incluyendo al sáculo como el receptor, al nervio vestibular inferior como la vía aferente(38), los núcleos vestibulares del tronco encefálico como centro integrador, al nervio espinal como vía eferente y al músculo esternocleidomastoideo (ECM) ipsilateral como efector final. Esta respuesta motora puede ser registrada a través de electrodos colocados sobre el ECM. La actividad electromiográfica en respuesta al estímulo es promediada (200 veces) y se obtiene una curva evocada que conoce como cVEMP (Figura 3)(39). Los cVEMP pueden ser evocados utilizando un estímulo auditivo de alta intensidad (90 a 100 dB nHL) conducido por aire (AC), una vibración transmitida a través de hueso (BC) o por medio de un estímulo eléctrico de corta duración, llamado estímulo galvánico (gVEMP). De estos tres estímulos el más utilizado es el conducido por aire(40). Se realiza el registro utilizando electrodos que deben ser colocados entre el tercio superior y punto medio del ECM y un electrodo de referencia sobre o cerca del esternón. Cuando se realiza un estímulo AC se produce una respuesta principalmente ipsilateral, mientras que cuando es BC se produce una respuesta bilateral por lo que se requiere registro electromiográfico de ambos ECMs(41). Las respuestas eléctricas de estos potenciales están compuestas de dos ondas bifásicas, la primera es positiva (inhibición) con una latencia de alrededor de 13 ms, conocida como p13, seguida por otra onda, negativa (excitación), con una latencia de 23 ms, conocida como n23 (Figura 3). Hoy en día estas ondas son llamadas p1 y n1, respectivamente, como una forma de estandarizar su nominación, debido a que su latencia es variable entre los distintos sujetos y pruebas(39,42-43). En la clínica el cVEMP es utilizado para la realización de diagnóstico, determinar extensión y seguimiento de patologías que afectan el sistema vestibular periférico y central. En este contexto, una de sus ventajas es que el reflejo persiste anormal incluso después de la compensación vestibular central (que se asocia a disminución de sintomatología)(44). Dentro de las aplicaciones clínicas de este examen encontramos la exploración en neuritis vestibular inferior (Figura 4)(45), síndrome de Meniere(46) y la dehiscencia del canal semicircular superior (SDCS), en la que se observan cVEMPs con umbrales disminuidos ≤ 70 dB nHL(47).
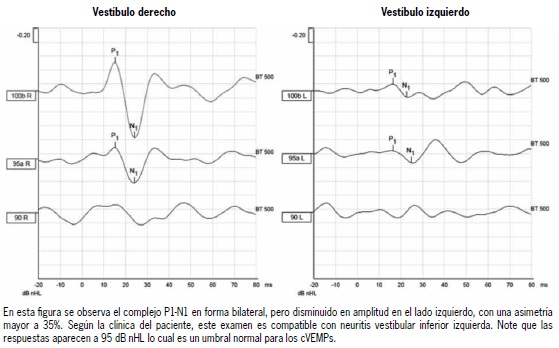
Figura 3. Asimetría de potenciales evocados miogénicos vestibulares cervicales (cVEMP )
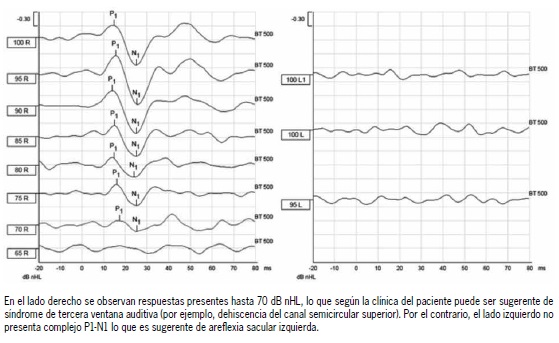
Figura 4. Disminución de umbrales de cVEMP s y ausencia de respuesta
VEMP OCULAR
Los oVEMPs son una herramienta más reciente que el cVEMP, cuyo propósito es principalmente la evaluación del reflejo vestíbulo-ocular que se origina en el utriculo(48). El circuito de este reflejo incluye al nervio vestibular superior, el cual es responsable de la estabilización de la visión, mediante el uso de los músculos extrínsecos oculares como efectores, durante movimientos cefálicos o corporales(49-50). Sin embargo, este reflejo también puede ser gatillado por vibraciones o sonidos de alta intensidad, siendo transmitidos tanto por vía ósea como área, estimulando así al utrículo sin necesidad de los movimientos cefálicos(51). Brevemente, un estímulo excitatorio utricular genera una respuesta excitatoria en el músculo oblicuo inferior y recto inferior del lado contralateral(50). Si bien los movimientos oculares evocados con sonido o vibración son muy pequeños, la actividad EMG puede ser registrada por electrodos de superficie colocados cerca de los ojos, pidiendo al paciente que mantenga la mirada hacia arriba logrando el registro de los oVEMP(48,52). El oVEMP se compone de una onda bifásica cuyo comienzo es una onda negativa con un peak de latencia promedio a los 10 ms (n10) seguido por una onda positiva cuyo peak se encuentra en promedio a los 15 ms (p15). La ausencia o atenuación del reflejo sugiere pérdida de función, si bien el rango de valores normales de la amplitud de las ondas es extenso, un reflejo anormalmente grande suele sugerir la presencia de una “tercera ventana móvil” en el laberinto, como la causada por síndrome de dehiscencia del canal semicircular superior(53).
El estudio de la función vestibular periférica y central con cVEMPs y oVEMPs es relativamente reciente, por lo que existen diversas investigaciones en curso para demostrar su utilidad en distintas patologías. Algunas patologías incluyen el estudio de la SDCS, neuritis vestibular inferior, esclerosis múltiple y déficit atencional en niños(54). En el SDCS se ha visto que el umbral de los cVEMPs para obtener respuesta es menor a 70 dB nHL, y además, la respuesta registrada en los oVEMPs es entre 5 a 20 veces mayor que en grupos control. En la neuritis vestibular inferior se reporta una asimetría mayor a un 35% entre las respuestas del lado derecho e izquierdo. Por otra parte, en sujetos con compromiso de las vías vestibulares centrales por esclerosis múltiple se reporta un retraso en la latencia de los VEMPs(55-56), mientras que en un grupo de niños con déficit atencional e hiperactividad, se reportan cVEMPs de amplitud disminuida(57).
CONCLUSIONES
Los estudios electrofisiólogicos del sistema auditivo han permitido el diagnóstico precoz de la hipoacusia del recién nacido y son un pilar fundamental de la audiología infantil a nivel mundial. Por otra parte el estudio con VEMPs permite evaluar de manera objetiva a reflejos vestíbulo-espinales y vestíbulo-oculares de los receptores otoliticos. Es importante resaltar que ninguno de estos estudios complementarios reemplaza a una adecuada y detallada anamnesis y a un meticuloso examen otoneurológico y oculomotor.
REFERENCIAS
1. Leon A, Elgueda D, Silva M, Hamamé C, Delano PH. Auditory Cortex Basal Activity Modulates Cochlear Responses in Chinchillas. PLoS One 2012;7:e36203.
2. Molholm S, Ritter W, Murray M, Javitt D, Schroeder C, Foxe J. Multisensory auditory– visual interactions during early sensory processing in humans: a high-density electrical mapping study. Brain Res Cogn Brain Res 2002;14:115-28.
3. Year 2007 Position Statement: Principles and Guidelines for Early Hearing Detection and Intervention Programs. Pediatrics 2007;120:898-921.
4. Wever E, Bray C. Action Currents in the auditory nerve in response to acoustical stimulation. Proc Natl Acad Sci USA 1930;16:344- 50.
5. Dallos P. The Auditory Periphery. Biophysics and Physiology. New York: Academic Press 1973;1:329-53.
6. Elgueda D, Delano PH, Robles, L. Effects of electrical stimulation of olivocochlear fibers in cochlear potentials in the chinchilla. J Assoc Res Otolaryngol 2011;12:317-27.
7. Ge X, Shea J. Transtympanic electrocochleography: A 10-year experience. Otol Neurotol 2002;23:799-805.
8. Moser T, Starr A. Auditory neuropathy — neural and synaptic mechanisms. Nat Rev Neurol 2016;12:135-49.
9. Claes G, De Valck C, Van de Heyning P, Wuyts F. The Ménière’s Disease Index. Otol Neurotol 2011;32:887-92.
10. Tanamati Li, Bevilacqua M, Costa O. Avaliação longitudinal do ECAP registrado em crianças usuárias de implante coclear. Rev Bras Otorrinolaringol 2009;5:90-8.
11. Millett D. Hans Berger: from psychic energy to the EEG. Perspect Biol Med 2001;44:522-42.
12. Davis PA. Effects of acoustic stimuli on the waking human brain. J Neurophysiol 1939;2:494-9.
13. Jewett D L, Romano M, Williston JS. Human auditory evoked potentials: possible brain stem components detected on the scalp. Science 1970;167:1517-8.
14. Jewett DL, Williston JS. Auditory-evoked far fields averaged from the scalp of humans. Brain 1971;94:681-96.
15. Petrova LD. Brainstem auditory evoked potentials. Am J Electroneurodiagnostic Technol 2009;49:317-32.
16. Berger JR, Blum AS. Brainstem auditory evoked potentials. En: The Clinical Neurophysiology Primer. N.J: Humana Press 2007;475-84.
17. Cueva R. Auditory brainstem response versus magnetic resonance imaging for the evaluation of asymmetric sensorineural hearing loss. Laryngoscope 2004;114:1686-92.
18. Thompson D, McPhillips H, Davis R, Lieu T, Homer C, Helfand M. Universal Newborn Hearing Screening. JAMA 2001;286:2000- 10.
19. Terreros G, Jorratt P, Aedo C, Elgoyhen A, Delano PH. Selective attention to visual stimuli using auditory distractors is altered in alpha-9 nicotinic receptor subunit knock-out mice. J Neurosci 2016;36:7198-209.
20. Santarelli R, Arslan E. Electrocochleography in auditory neuropathy. Hear Res 2002;170:32-47.
21. Ministerio de Salud de Chile. Hipoacusia moderada en menores de 2 años. Santiago: Minsal, 2013.
22. Ministerio de Salud de Chile, Hipoacusia neurosensorial bilateral del prematuro, Santiago: Minsal, 2010.
23. Radeloff A, Cebulla M, Shehata-Dieler W. Auditory evoked potentials: basics and clinical applications. Laryngorhinootologie 2014,93:625-37.
24. Ferraro J, Durrant JD. auditory evoked potentials: overview and basic principles. En Katz J, ed. Handbook of clinical Audiology. Philadelphia: Lippincott Willimas & Wilkins, 1994;317-38.
25. Cañete O. Potenciales evocados auditivos de corteza: Complejo P1-N1-P2 y sus aplicaciones clínicas. Rev Otorrinolaringol Cir Cabeza Cuello 2014;74:266-74.
26. Tremblay K, Kraus N, McGee T, Ponton C, Otis B. Central auditory plasticity: changes in the N1-P2 complex after speech-sound training. Ear Hear 2001;22:79-90.
27. Brown CJ, Jeon EK, Chiou LK, Kirby B, Karsten SA, Turner CW et al. Cortical auditory evoked potentials recorded from nucleus hybrid cochlear implant users. Ear Hear 2015;36:723-32.
28. Carrasco M, Pavez A, Delano PH. Potencial de disparidad. Rev. Otorrinolaringol Cir Cabeza Cuello 2008;68:185-92.
29. Ulanovsky N, Las L, Nelken I. Processing of low-probability sounds by cortical neurons. Nat Neurosci 2003;6:391-8.
30. Malmierca M, Anderson LA, Antunes F M. The cortical modulation of stimulus-specific adaptation in the auditory midbrain and thalamus: a potential neuronal correlate for predictive coding. Front Syst Neurosci 2015;9:19.
31. Korczak P, Smart J, Delgado R, Strobel TM, Bradford C. Auditory steady-state responses. J Am Acad Audiol 2012;23:146-70.
32. Galambos R, Makeig S, Talmachoff P. A 40-Hz auditory potential recorded from the human scalp. Proc Natl Acad Sci U S A 1981;78:2643–7.
33. Delano PH, Robles L, Pavez E, Maldonado P. Stimulus-dependent oscillations and evoked potentials in chinchilla auditory cortex. J Comp Physiol 2008;194:693-700.
34. Baltus A, Herrmann CS. The importance of individual frequencies of endogenous brain oscillations for auditory cognition–A short review. Brain Res 2016;1640:243-50.
35. Kemp D. Stimulated acoustic emissions from within the human auditory system. J Acoust Soc Am 1978;64:1386-91.
36. Alvo A, Der C, Delano PH. Tamizaje universal de hipoacusia en el recién nacido. Rev Hosp Clín Univ Chile 2010;21:170-6.
37. Honaker J, Samy R. Vestibular-evoked myogenic potentials. Current opinion in otolaryngology & head and neck surgery 2007;15:330- 4.
38. Meyer N, Vinck B, Heinze B. cVEMPs: A systematic review and meta-analysis. International J Audiolog 2015; 54:143-51.
39. Cal R, Bahmad JR. Vestibular evoked myogenic potentials: an overview. Braz J Otorhinolaryngol 2009;75:456-62.
40. Eleftheriadou A, Koudonarakis E. Vestibularevoked myogenic potentials eliciting: an overview. Eur Arch Otorhinolaryngol 201;268:331-9.
41. Papathanasiou ES, Murofushi T, Akin FW, Colebatch JG. International guidelines for the clinical application of cervical vestibular evoked myogenic potentials: an expert consensus report. Clin Neurophysiol 2014;125:658- 66.
42. Rosengren S, Welgampola M, Colebatch J. Vestibular evoked myogenic potentials: past, present and future. Clin Neurophysiol 2010;121:636-51.
43. Welgampola M, Colebatch J. Characteristics and clinical applications of vestibularevoked myogenic potentials. Neurology 2005;64:1682-8.
44. Mudduwa R, Kara N, Whelan D, Banerjee A. Vestibular evoked myogenic potentials: review. J Laryngol Otol 2010;124:1043-50.
45. Brantberg K, Löfqvist L, Westin M, Tribukait A. Skull tap induced vestibular evoked myogenic potentials: an ipsilateral vibration response and a bilateral head acceleration response?. Clin Neurophysiol 2008;119:2363-9.
46. Taylor RL, Wijewardene AA, Gibson WP, Black DA, Halmagyi GM, Welgampola MS. The vestibular evoked-potential profile of Ménière’s disease. Clin Neurophysiol 2011;122:1256-63.
47. Hunter J, Patel N, O’Connell B, Carlson M, Shepard N, McCaslin D et al. Cervical and Ocular VEMP Testing in Diagnosing Superior Semicircular Canal Dehiscence. Otol Neurotol 2013;34:121–6.
48. Todd N, Rosengren SM, Aw ST, Colebatch JG. Ocular vestibular evoked myogenic potentials (OVEMPs) produced by air-and bone-conducted sound. Clin Neurophysiol 2007;118:381-90
49. Park HJ, Lee IS, Shin JE, Lee YJ, Park MS. Frequency-tuning characteristics of cervical and ocular vestibular evoked myogenic potentials induced by air-conducted tone bursts. Clin Neurophysiol 2010;121:85-9.
50. Felipe L, Kingma H. Ocular vestibular evoked myogenic potentials. Int Arch Otorhinolaryngol 2014;18:77-9.
51. Karlberg M, Aw ST, Black RA, Todd MJ, MacDougall HG, Halmagyi GM. Vibrationinduced ocular torsion and nystagmus after unilateral vestibular deafferentation. Brain 2003;126:956-64.
52. Welgampola MS, Migliaccio AA, Myrie OA, Minor LB, Carey JP. The human soundevoked vestibulo-ocular reflex and its electromyographic correlate. Clin Neurophysiol 2009;120:158-66.
53. Alzérreca E, Pardo J, Salas A, Walker K, Delano PH. Dehiscencia del canal semicircular superior, un nuevo diagnóstico en pacientes con vértigo. Rev Hosp Clín Univ Chile 2011;22:310-7.
54. Weber K, Rosengren S. Clinical utility of ocular vestibular-evoked myogenic potentials (oVEMPs). Curr Neurol Neurosci Rep 2015;15:22.
55. Welgampola M. Evoked potential testing in neuro-otology. Curr Opin Neurol 2008;21:29-35.
56. Zhou G, Cox L C. Vestibular evoked myogenic potentials history and overview. Am J of Audiol 2004;13:135-43.
57. Isaac V, Olmedo D, Aboitiz F, Delano PH. Altered cervical vestibular-evoked myogenic potential in children with attention deficit and hyperactivity disorder. Front Neurol 2017;13;8:90.
AGRADECIMIENTOS
Paul Delano es financiado por Proyecto Anillo-ACT1403 y por Proyecto Fondecyt 1161155.
Correspondencia:
Dr. Paul H. Délano
Servicio Otorrinolaringología, Hospital Clínico de la Universidad de Chile
[email protected]
562 2978 9084