Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Capacidad antiangiogénica comparada de celecoxib y anticuerpos neutralizantes anti-VEGF en un modelo in vivo
Introduction: A common feature in cancer is the development of angiogenesis, defined as the formation of blood vessels from preexisting ones, highly developed in malignant neoplasms to establish the prevalence of angiogenic factors over anti-angiogenic factors, which in physiological conditions are balanced. While there are currently several antiangiogenic therapies, the compared effect of celecoxib and anti-VEGF antibodies has not been performed on an in vivo model, such as chick chorioallantoid membrane (CAM). Materials and Methods: In this investigation, Methotrexate-resistant TA3 tumor supernatant (TA3-MTX-R) was instilled on the CAM, where a group was also treated with anti-VEGF165 antibodies (20 μg/mL) and another was treated with celecoxib in a concentration of 1000 ppm. Samples were processed histologically and stained with Hematoxylin Eosin-Alcian Blue. Double blind in blood vessels counting was performed using an optical microscope at 400x. Results: Both treatments promote reduced vascular density, where group treated with anti-VEGF antibodies was more antiangiogenic than group treated with celecoxib (p < 0.05). Conclusions: anti-angiogenic anti-VEGF potential and its greater efficacy compared with celecoxib is evident, due to their different mechanisms of action. Future studies should involve the co-adjuvant effect between celecoxib and anti-VEGF in cancer patients resistant to treatment with methotrexate.
Rev Hosp Clin Univ Chile 2014; 25(2): 97-103
Julio Vargas O., Sergio Vera N., Andrés Zerega R., Mariana Sinning O., Marcela Fuenzalida B., Carlos Rosas C.
El cáncer constituye la segunda causa de muerte en nuestro país, luego de los accidentes cardiovasculares. Entre los diferentes mecanismos fisiopatológicos involucrados en el crecimiento tumoral, se encuentra la angiogénesis. Esta comprende la formación de vasos sanguíneos a partir de otros preexistentes. Es fisiológica en el desarrollo embrionario, cicatrización y el ciclo menstrual, pero patológica en cuadros de neoplasias malignas(1).
La capacidad del tumor de progresar desde un fenotipo no angiogénico a uno angiogénico es fundamental en la progresión del cáncer. Al establecerse una prevalencia de factores proangiogénicos por sobre los antiangiogénicos, se desencadena la angiogénesis y con ella, la expansión tumoral. Este angiogenic switch propuesto por Folkman y Watson en 1989, transcurre mediante una serie de etapas: primero, las células tumorales expresan más proteínas angiogénicas como factor de crecimiento vascular endotelial (VEGF) o factor de crecimiento fibroblástico 2 (FGF2), y más tarde, lo hacen las células estromales. Luego decrece la expresión de inhibidores endógenos de la angiogénesis por parte de ambos tipos celulares.
Como la respuesta angiogénica surge ante condiciones de hipoxia o isquemia(2), el VEGF actúa aumentando la permeabilidad vascular y participando como factor antiapoptótico en las células endoteliales de los nuevos vasos formados(3), promoviendo la potencialidad metastásica del tumor en formación. De sus variantes, el VEGF-A es el factor más importante en la angiogénesis, al estimular la síntesis de proteasas, migración y proliferación de las células endoteliales(4). Existen estudios donde se bloqueó la expresión del VEGF en cuestión, mediante la utilización de sorafenib y sunitinib, que interactuaban con el receptor de tirosina kinasa KDR o VEGFR-2(5), en los cuales disminuyó la angiogénesis.
Por otra parte, se ha estudiado el efecto del uso de antiinflamatorios sobre el crecimiento tumoral. La expresión elevada de la enzima Ciclooxigenasa 2 (COX-2, involucrada en la síntesis de prostaglandinas) ha sido reportada en una gran cantidad de tumores, dada su expresión inducida por mitógenos, citoquinas y promotores de tumores(6). Investigaciones demuestran que la sobreexpresión de COX-2, bajo determinadas condiciones, facilita la formación de tumores mediante variados mecanismos, entre ellos la angiogénesis(7).
Así, COX-2 se perfila como un potente blanco terapéutico de los antiinflamatorios no esteroidales en el cáncer, como celecoxib (Celebra®), el primer fármaco específico en el bloqueo de COX-2. En estudios experimentales, la administración periódica de celecoxib causó una significativa reducción en la presencia de pólipos colorrectales, y además, ha mostrado ser un eficiente inhibidor de tumorigénesis y angiogénesis en modelos animales(6).
De este modo, se estudiará el efecto sobre la angiogénesis del bloqueo de VEGF, usando un anticuerpo policlonal anti-VEGF165, que inhibe su actividad biológica(8). Se pretende comparar el efecto de este anticuerpo y de celecoxib sobre la angiogénesis inducida por sobrenadante de células tumorales resistentes a metotrexato (MTX), evaluando la variación de la densidad vascular frente a anti-VEGF y frente a celecoxib en un modelo in vivo de membrana alantocoriónica de pollo (MAC).
MATERIALES Y MÉTODOS
Se utilizaron 60 huevos de pollo Gallus gallus de raza White Leghorn embrionados, obtenidos del Instituto de Salud Pública, y se estudió la membrana alantocoriónica para analizar la densidad microvascular, de acuerdo a lo descrito previamente(9,10). Brevemente, los huevos fueron incubados a 37º C en una cámara humidificada. A las 48 horas de cultivo, se perforó la cámara de aire para extraer aproximadamente 2 mL de albúmina con una pipeta Pasteur. Realizado el procedimiento, se desinfectó el área con una solución de alcohol yodado y se tapó con cinta adhesiva. Luego se realizó a nivel dorsal y en forma estéril una ventana de 2,5 cm. de ancho por 2 cm. de largo, manteniendo la misma orientación con la que fue incubada anteriormente.
A los 8 días de incubación en la cámara a 37°C se ubicó un filtro de metilcelulosa sobre las MAC en las zonas donde se observaba mayor desarrollo de vasos sanguíneos, agregándose sobre ellos 10 μ L de las siguientes sustancias:
1. Sobrenadante tumoral de tumor TA3: obtenido a partir de células tumorales de crecimiento ascítico provenientes de una línea tumoral TA3 resistente a MTX11 (TA3-MTXR) y portadas por ratones de la cepa AJ. Estas células son seleccionadas a partir de traspasos sucesivos del fluido ascítico de los ratones, tratados por vía peritoneal con MTX con una dosis de 0,1 mg/kg/48 hrs. Las células TA3-MTX-R se obtienen al sexto día post inoculación intraperitoneal de células tumorales, contenidas en el flujo ascítico de los ratones. Los ratones son eutanasiados y se obtiene el líquido ascítico, el cual se centrifuga a 3500 rpm por 10 minutos para obtener el sobrenadante tumoral.
2. Anti-VEGF: anticuerpo policlonal anti-VEGF 165 (Millipore®, Billerica MA, USA), a una concentración de 20μg/mL. Se instilan 10 μ L sobre las MAC destinadas a recibirlo.
3. Celecoxib: se usa el fármaco Celebra® 200 mg (Pfizer®), diluido en H2O destilada en una concentración de celecoxib 1000 ppm (200 mg en 200 ml de H2O destilada).
Se diseñaron los siguientes grupos de experimentación:
• Grupo 1 control (n=15): 10 μ L de H2O destilada.
• Grupo 2 (n=15): 10 μ L de sobrenadante tumoral.
• Grupo 3 (n=15): 10 μ L de sobrenadante tumoral + 10 μL de anti-VEGF (20mg/ml).
• Grupo 4 (n=15): 10 μ L de sobrenadante tumoral + 10 μ L de celecoxib 1000 ppm.
A las 48 horas postaplicación de las soluciones, se extrajeron los filtros con MAC y se procedió a la fijación de las muestras en formalina tamponada al 10% por 48 horas. Las muestras fueron procesadas histológicamente para obtener cortes seriados de 5 μ m, los que fueron teñidos con hematoxilina-eosina-azul alcián, esto último para la tinción del filtro.
Para el conteo de vasos sanguíneos se utilizó un microscopio de luz binocular con cuadrícula de 0,5 cm2 en uno de sus oculares, contándose un área aproximada de 120 campos por grupo en el sector cercano al filtro de metilcelulosa (9000 μm2), en modalidad doble ciego; las imágenes fueron capturadas en un microscopio óptico Olympus CX31 a 400X de aumento con ayuda del software Accu-Scope Micrometrics®.
Para el estudio estadístico se utilizó ANOVA con la prueba de Tukey, con un intervalo de confianza del 95%, mediante el software estadístico GraphPad Prism 5, comparándose todos los datos de los grupos entre sí.
RESULTADOS
El número de vasos sanguíneos promedio fue de 12,81 ± 0,34 para el grupo control, 24,82 ± 0,63 para el grupo expuesto a sobrenadante de tumor TA3-MTX-R, 7,26 ± 0,41 para el grupo expuesto a sobrenadante tumoral y al anticuerpo anti-VEGF y 11,36 ± 0,22 para el grupo instilado con sobrenadante tumoral y celecoxib. El detalle de los resultados obtenidos se muestra en la Tabla 1 y se representan en la Figura 1 y 2.
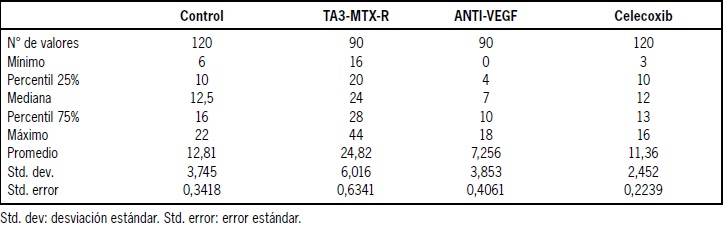
Tabla 1: Detalles del conteo ciego de vasos sanguíneos realizados en una superficie de 9000 μm2.
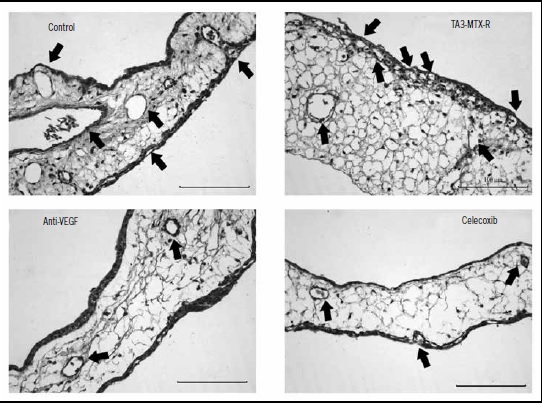
Figura 1. Microfotografía representativa de las MAC de cada grupo. Cortes seriados de 5μm fueron teñidos con H&E-azul alcián y observadas en un microscopio a 400x para contabilizar los vasos sanguíneos presentes (flecha negra) en el tejido. La barra inferior derecha representa 100 μm.
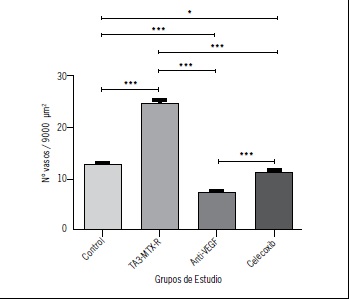
Figura 2. Gráfico que muestra la densidad microvascular en 9000 μm2 de MAC de los distintos grupos. Control corresponde al grupo instilado con agua destilada; TAX3-MTX-R es el grupo instilado con sobrenadante de tumor TA3 resistente a MTX; anti-VEGF representa al grupo instilado con sobrenadante tumoral y el anticuerpo anti-VEGF; y celecoxib corresponde al grupo instilado con el sobrenadante y con el fármaco celecoxib. (*: p < 0.05, ***: p < 0,0001)
Los resultados estadísticos obtenidos con ANOVA se detallan en la Tabla 2 y las comparaciones realizadas fueron las siguientes:
Control vs. TA3-MTX-R. Existe mayor número promedio de vasos sanguíneos en las muestras expuestas al sobrenadante de tumor TA3-MTX-R respecto del grupo control (p < 0,0001).
Control vs. anti-VEGF. El número promedio de vasos sanguíneos en el grupo control fue mayor que en el grupo anti-VEGF, con una diferencia estadísticamente significativa (p < 0,0001).
Control vs. celecoxib. Se encontró un mayor número promedio de vasos en el grupo control respecto del grupo expuesto a celecoxib, con un p < 0,05.
TA3-MTX-R vs. anti-VEGF. La considerable diferencia entre el número promedio de vasos sanguíneos del grupo TA3-MTX-R y el grupo anti-VEGF es estadísticamente significativa (p <0,0001), observándose mayor cantidad de vasos promedio en el grupo instilado con el sobrenadante tumoral.
TA3-MTX-R vs. celecoxib. La diferencia entre los grupos TA3-MTX-R y celecoxib es estadísticamente significativa (p < 0,0001), con mayor número promedio de vasos sanguíneos en el grupo TA3-MTX-R.
Anti-VEGF vs. celecoxib. Finalmente, la diferencia entre los grupos expuestos a anti-VEGF y a celecoxib fue estadísticamente significativa (p < 0,0001), encontrándose menor cantidad promedio de vasos sanguíneos en el grupo instilado con el anticuerpo anti-VEGF.
DISCUSIÓN
Al comparar el grupo expuesto a anti-VEGF con los tres grupos restantes, se observó en todos los casos una mayor disminución en la densidad microvascular por parte de este grupo, demostrándose así que anti-VEGF posee un potente efecto antiangiogénico al aplicarlo sobre MAC instilada con sobrenadante tumoral de Tumor TA3, induciendo una menor densidad vascular en ella. Esto se debe al bloqueo de la unión de VEGF a su receptor de membrana por parte del anticuerpo, evitando así la transducción de señales que derivarán en la angiogénesis tumoral.
Al comparar el grupo con celecoxib y sobrenadante tumoral con los grupos control y TA3-MTX-R, respectivamente, se observó una disminución estadísticamente significativa de la cantidad de vasos sanguíneos promedio, dada por la inhibición de la acción de la enzima COX-2, cuya sobreexpresión es responsable de diversos mecanismos que facilitan la formación de tumores, entre ellos la angiogénesis. De esta forma, se corrobora que celecoxib posee también un alto efecto antiangiogénico.
Dado lo anterior, se realizó otra comparación entre el efecto de anti-VEGF sobre la MAC instilada con el sobrenadante tumoral y el efecto del fármaco celecoxib. Se observó menor densidad microvascular en el grupo expuesto a anti-VEGF, con una diferencia estadísticamente significativa en relación al grupo expuesto a celecoxib, quedando demostrada una mayor efectividad del anticuerpo anti-VEGF en el tratamiento contra la angiogénesis tumoral en MAC. La mayor efectividad anti-angiogénica de éste radicaría en su bloqueo directo de VEGF y anterior en la vía de la angiogénesis respecto a celecoxib, que actúa en forma mucho más indirecta por la vía de las prostaglandinas, como se ha esquematizado en trabajos previos(12).
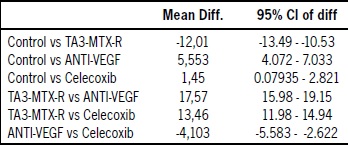
Tabla 2: Análisis estadístico de densidad vascular. Muestra la aplicación del test de comparación múltiple de Tukey (ANOVA) que establece una comparación entre los distintos grupos con respecto a la cantidad de vasos sanguíneos promedios en las MAC instiladas con agua destilada, sobrenadante de tumor TA3-MTX-R, anti-VEGF + sobrenadante, y celecoxib + sobrenadante tumoral. Mean Diff: diferencia entre los promedios de los vasos sanguíneos de los grupos comparados. 95% CI of diff: muestra el intervalo de confianza de 95%.
En vista de que el anticuerpo anti-VEGF posee un poderoso efecto en la reducción de la densidad microvascular en MAC instilada con sobrenadante tumoral, y de que celecoxib también es efectivo bloqueando la angiogénesis, podría probarse en clínica un tratamiento con ambas sustancias en pacientes con cáncer. La utilización de ambos productos podría usarse como una vía terapéutica alternativa en pacientes que son resistentes a terapias con MTX, basado en los resultados obtenidos durante la investigación.
En vista de que ya se han utilizado tratamientos por separado contra el cáncer, usando anti-VEGF monoclonal y celecoxib, obteniéndose resultados favorables, el uso de ambos fármacos en forma simultánea podría potenciar el efecto antiangiogénico, al bloquear este mecanismo por dos vías distintas, frenando la expansión tumoral y la progresión del cáncer.
Sería recomendable utilizar una terapia metronómica, administrando agentes antiangiogénicos a bajas dosis y a intervalos cortos y regulares sin interrumpir el tratamiento. Estudios previos demuestran que esta terapia ha sido eficaz para disminuir la angiogénesis tumoral(13). O bien, podría efectuarse una terapia secuencial, donde los fármacos se administren en fases consecutivas, empezando con dosis bajas, para luego ir variando las concentraciones de las sustancias antiangiogénicas descritas e ir observando la progresión tumoral a través de biopsias. Esto, con el objetivo de evitar reacciones adversas al tratamiento, tales como un posible aumento en la densidad microvascular.
REFERENCIAS
1. Lee S, Rosen, MD. Clinical experience with angiogenesis signaling inhibitors: focus on vascular endothelial growth factor (VEGF) blockers. Cancer Control 2002;9:36-44.
2. Griffioen AW, Molena, G. Angiogenesis: Potentials of pharmacologic intervention in the treatment of cancer, cardiovascular diseases, and chronic inflammation. Pharmacological Reviews 2000:52:237-67.
3. Kerbel R. Tumor angiogenesis: past, present and the near future. Carcinogenesis 2000;21:505-15.
4. Sato Y, Sonoda H. The Vasohibin Family. A negative regulatory system of angiogenesis genetically programmed in endothelial cells. Aterioscler Thromb Vasc Biol 2007;27:37-41.
5. Bergers G, Hanahan D. Modes of resistance to anti-angiogenic therapy. Nat Rev Cancer 2008;8:592-603.
6. Chun K, Surh Y. Signal transduction pathways regulating cyclooxygenase-2 expression: potential molecular targets for chemoprevention. Biochem Pharmacol 2004;68:1089-100.
7. Liu CH, Chang SH, Narko K, Trifan OC, Wu MT, Smith E et al. Overexpression of cyclooxygenase-2 is sufficient to induce tumorigenesis
in transgenic mice. J Biol Chem 2001;276:18563-9.
8. Bressler SB. Introduction: Understanding the Role of Angiogenesis and antiangiogenic Agents in Age-Related Macular Degeneration. Ophthalmology 2009;116:S1-7.
9. Lemus D, Dabancens A, Illanes J, Fuenzalida M, Guerrero A, López C. Antiangiogenic effect of betamethasone on the chick cam stimulated by TA3 tumor supernatant. Biol Res 2001;34:227–36.
10. Ribatti D, Nico B, Vacca A, Roncali L, Burri PH, Djonov V. Chorioallantoic membrane capillary bed: a useful target for studying angiogenesis and anti-angiogenesis in vivo. Anat Rec 2001;264:317–24.
11. Guerrero A, Zipper J, Dabancens A. Actividad antineoplásica ejercida por Quinacrina oral sobre tumores malignos transplantables en ratón. Revista Chilena de Cancerología y Hematología 1992;2:119-22.
12. Konturek PC, Konturek SJ, Brzozowski T. Gastric cancer and Helicobacter pylori infection. J Physiol Pharmacol 2006;57:51–5.
13. Elmslie RE, Glawe P, Dow SW. Metronomic therapy with cyclophosphamide and piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. J Vet Intern Med 2008;22:1373-9.
Correspondencia:
 Dr. Carlos Rosas Chuñil
Dr. Carlos Rosas Chuñil
 Laboratorio de Embriología Experimental y Molecular, ICBM, Facultad de Medicina, Universidad de Chile
Laboratorio de Embriología Experimental y Molecular, ICBM, Facultad de Medicina, Universidad de Chile
 [email protected]
[email protected]
 562 2978 6262 / 562 2978 6453
562 2978 6262 / 562 2978 6453