Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Asociación entre polimorfismos en los genes PNPLA3 y TM6SF2 y presencia de fibrosis en pacientes con infección crónica por virus hepatitis C
Hepatitis C virus (HCV) is a globally prevalent pathogen and a leading cause of death and morbidity. The most recent estimates of disease burden show an increase in seroprevalence over the last 15 years to 2.8%, equating to >185 million infections worldwide. Persistent hepatitis C infection is associated with the development of liver cirrhosis, hepatocellular cancer, liver failure and death. The magnitude of disease progression in chronic infection varies significantly among individuals. Several factors have been recognized as being associated with the progression of HCV-related liver fibrosis and with clinical outcomes. As liver fibrosis progression remains variable between individuals with similar environmental or virological risks, host genetic predispositions have been suggested as another critical determinant. The single nucleotide polymorphisms in Patatin-like phospholipase domain-containing 3 (PNPLA3) and Transmembrane 6 Superfamily Member 2 (TM6SF2) genes are genetic determinants of nonalcoholic fatty liver disease, in terms of inflammation and fibrosis. The possible action of the PNPLA3 and TM6SF2 polymorphisms on fibrosis development in chronic hepatis C is being studied, with controversial results.
Rev Hosp Clin Univ Chile 2015; 26(4): 329-35.
Álvaro Urzúa M., Javier Brahm B., Julio Miranda B., Laura Carreño T., Mauricio Venegas S.
La infección crónica por el virus hepatitis C (VHC) es un problema de salud pública mundial, ya que se estima que existen aproximadamente 185 millones de personas infectadas(1). En Chile, un estudio poblacional de prevalencia de anticuerpos anti-VHC en una muestra de 959 personas ≥ 20 años de edad, en la comuna de La Florida de la Región Metropolitana, reveló una seroprevalencia de 0,8%, de los cuales el 62,5% fue virémico(2). Basados en estos resultados, se estimaba que para el año 2010 habría aproximadamente 64.000 pacientes con infección crónica por el VHC en el país.
Muchas de las personas infectadas con VHC desarrollan complicaciones como fibrosis, cirrosis y carcinoma hepatocelular, siendo éstas una de las causas más frecuentes de trasplante hepático(3). La magnitud de la progresión de la enfermedad hepática por VHC varía significativamente entre los individuos infectados. Varios factores han sido correlacionados con el curso clínico y desarrollo de fibrosis relacionada a infección por VHC, incluyendo edad de los pacientes, tiempo de infección, coinfección con virus hepatitis B o virus de la inmunodeficiencia humana, alcoholismo, obesidad y esteatosis hepática(4-6). Debido a que la progresión de la fibrosis hepática aun es diferente entre individuos con similares factores de riesgos virológicos y medioambientales, se ha sugerido que una predisposición genética puede ser otro determinante crítico(7,8).
La proteína PNPLA3 (Patatin-like phospholipase domain-containing 3) es una triacilglicerol lipasa de 481 aminoácidos, cuya expresión génica en hígado es 10 veces más alta que en tejido adiposo(9). El polimorfismo de nucleótido único (SNP) rs738409 en el gen de PNPLA3, ubicado en el cromosoma 22, en que existe una transversión de citosina (C) por guanina (G), la que a su vez codifica la variante I148M (cambio del aminoácido isoleucina por metionina) y que fue descubierto en 2008, ha sido identificado como un determinante genético de la enfermedad por hígado graso no alcohólico (HGNA) en términos de esteatosis, inflamación y fibrosis hepática(10,11). El mecanismo molecular por el cual este polimorfismo se asocia a HGNA no está completamente dilucidado, pero la hipótesis actual se relaciona con la actividad esterasa de la enzima. La variante I148M pierde actividad, se acumula en los cuerpos lipídicos o adiposomas e inhibe la acción de otras lipasas, estimulando la acumulación de triglicéridos en los hepatocitos(12) (Figura 1).
Figura 1. Modelo del mecanismo molecular por el cual el polimorfismo rs738409 (I148M) del gen PNPLA3 influye en el desarrollo de HGNA. Al lado izquierdo se observa la enzima con polimorfismo C, con actividad normal, sin acumulación de grasas. En el lado derecho la enzima con polimorfismo G, que impide la actividad de otras lipasas, directamente o indirectamente a través bloqueo de co-factores. (Modificado de Dongiovanni P et al.)
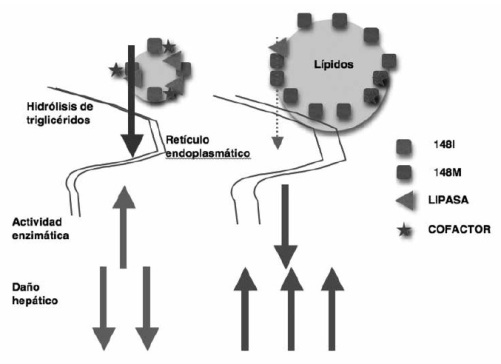
Existe asociación entre este polimorfismo y la severidad de la enfermedad hepática por VHC, aunque los datos son controversiales(13-16).
Un estudio colaborativo realizado con pacientes caucásicos franceses, alemanes y belgas infectados con VHC encontró que el genotipo homocigoto GG en rs738409 tenía una frecuencia de 2,2 %, 7 % y 10 %, respectivamente. Este genotipo se asoció significativamente a esteatosis hepática (OR 2,55, p=0,034) y a fibrosis (OR 3,13; p=0,002)(13).
En un trabajo de similares características realizado en Italia con dos series independientes de pacientes con VHC, el genotipo homocigoto GG fue encontrado en el 10% de los pacientes y se encontró asociación con esteatosis (OR 1,9; p menor que 0,001), independiente de otros factores como edad, sexo, IMC, diabetes y consumo de alcohol. En este mismo estudio este genotipo fue asociado con fibrosis y cirrosis hepática (OR 1,47; p=0,002)(14).
En contraste a lo anterior, en un estudio multicéntrico español en que el porcentaje de pacientes homocigotos GG fue de 5,1%, hubo asociación entre este genotipo con presencia de esteatosis hepática en pacientes con VHC, pero no se encontró influencia de esta variante con el grado de fibrosis(15).
Más discordante aún es un trabajo japonés en que se genotipificaron 260 pacientes con infección crónica por VHC y no se encontró asociación entre el polimorfismo rs738409 y presencia de hígado graso o cirrosis hepática(16). El porcentaje de pacientes homocigotos GG en este estudio fue de 21,2 %.
En Chile existe un estudio del polimorfismo rs738409 del gen PNPLA3 realizado en pacientes con hígado graso no alcohólico (HGNA), patología en la cual esta variante genética ha demostrado ampliamente ser un factor asociado. En dicho trabajo realizado en 166 pacientes se encontró una alta prevalencia del genotipo homocigoto GG (39%), asociándose a la presencia de esteatosis hepática (OR 1,98; p=0,001), pero no a la presencia de fibrosis(*).
Más recientemente nuestro grupo estudió la presencia del polimorfismo rs738409 del gen PNPLA3 en pacientes con infección crónica por VHC. En este trabajo que incluyó a 145 pacientes, 93 con estadio F0-F2 según la clasificación de METAVIR y 52 con estadio F3-F4, se encontró una alta prevalencia del genotipo homocigoto (59%), similar a lo publicado en pacientes HGNA, asociándose la variante a hígado graso (OR 2,56; p=0,014), pero no a fibrosis(**) al igual que en el trabajo español(15).
La ausencia de relación entre este polimorfismo y fibrosis en nuestros pacientes con VHC, que es similar a lo encontrado por los japoneses(16) y distinto a lo descrito en franceses(13) e italianos(14) no es sorpresivo, ya que los porcentajes de genotipo homocigoto GG en las poblaciones europeas mencionadas es mucho menor, por lo que el impacto del factor es mayor. Además filogenéticamente, los chilenos son más parecidos a españoles y japoneses, poblaciones en las que no se encontró relación con fibrosis. Esto es concordante con lo descrito en un reciente metaanálisis que demuestra que la variante I148M del polimorfismo se asocia a fibrosis en caucásicos, pero no en asiáticos(17). En este metaanálisis no se incluye un grupo hispánico, lo que sugiere que además de los resultados preliminares en nuestra población se debe investigar su presencia en mayor número de individuos antes de sacar conclusiones.
Otra variante genética descubierta más recientemente que PNPLA3, es la que ocurre en el gen Transmembrane 6 superfamily member 2 (TM-6SF2), ubicado en el cromosoma 19 y que se ha asociado a la presencia de esteatosis, esteatohepatitis y fibrosis hepática(18).
El SNP rs58542926 en el gen de TM6SF2 condiciona una transición de citosina por timina, que a su vez codifica una variante en que glutamato pasa a lisina en el residuo 167 (E167K) de la proteína(19). El mecanismo de acción de esta proteína es desconocido, pero la evidencia actual sugiere que este gen actuaría como un switch según el alelo presente, siendo la variante rs58542926 con alelo T (167K), asociada a retención de triglicéridos y colesterol hepáticos, confiriendo mayor riesgo de HGNA, fibrosis y cirrosis y la variante con alelo C (167E), asociada a dislipidemia y mayor riesgo cardiovascular(19) (Figura 2). En un primer estudio que incluyó a 2.736 individuos, este polimorfismo se asoció a la presencia de esteatosis hepática(19) y un estudio posterior realizado en 1.074 pacientes lo asoció a la severidad de fibrosis en HGNA (OR, 1.88 [95% IC, 1.41–2.5])(20).
Figura 2: Modelo del mecanismo molecular por el cual el polimorfismo rs58542926 (E167K) del gen TM6SF2 influye en el desarrollo de HGNA. Arriba la variante 167E (alelo C) del polimorfismo, en que la enzima aumenta la excreción de triglicéridos (Tg), principalmente en forma de VLDL (very low density lipoprotein). En el esquema inferior, la enzima con variante 167K (aleloT) no tiene capacidad de eliminar los triplicéridos, acumulándose en los hepatocitos. (Modificado de Dongiovanni P et al.)
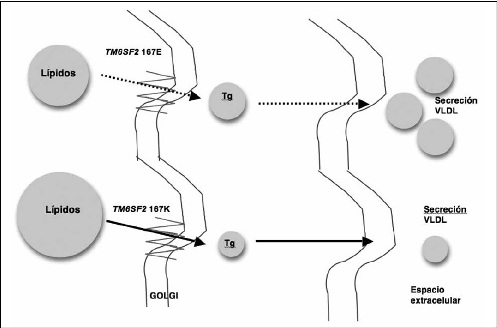
La información publicada entre asociación entre este polimorfismo y la severidad de la enfermedad hepática por VHC es escasa, existiendo sólo 3 trabajos publicados, siendo en 2 de estos la asociación positiva. En el primero, en que se incluyeron 148 pacientes italianos, se encontró un score de esteatosis mayor en pacientes con el polimorfismo heterocigoto E167K (CT) en comparación con el homocigoto E167 (CC), sin encontrar diferencias en grado de inflamación o fibrosis(21). En el segundo se incluyeron 815 pacientes, también italianos, y se observó una relación entre la variante E167K y grado de esteatosis, inflamación, fibrosis y además la probabilidad de cirrosis. Estos hallazgos se replicaron en 645 pacientes alemanes y suizos, estableciendo relación entre la variante E167K y fibrosis significativa en la biopsia(22). El tercer estudio de publicación más reciente que incluyó a 694 pacientes caucásicos portadores de infección por VHC, todos genotipo 1, reportó un 6,3% de prevalencia del polimorfismo heterocigoto, sin encontrar asociación entre éste y esteatosis o fibrosis. Destaca en este estudio que la prevalencia y severidad de la esteatosis fue menor en los portadores del alelo C (E167) y que además los niveles plasmáticos de colesterol y triglicéridos eran menores en los heterocigotos (E167K o CT), lo que es concordante con la hipótesis fisiopatológica de que esta enzima promueve más la acumulación de grasa en el hígado o en la circulación, dependiendo de los alelos presentes(23).
En Latinoamérica existe un estudio publicado en población argentina del polimorfismo rs58542926 TM6SF2 en pacientes con HGNA, que sugiere que la presencia del alelo T se asocia a mayor acumulación de grasa hepática y desarrollo de esteatohepatitis(24); sin embargo, no hay estudios en pacientes con hepatitis C. Por este motivo nuestro grupo tiene actualmente como objetivo el estudio de este polimorfismo en población chilena portadora de VHC y analizar su relación con esteatosis y fibrosis.
Al igual que en otras disciplinas de la Medicina, en Hepatología la predisposición genética cada vez reviste más importancia como determinante en el desarrollo de las enfermedades, en su progresión y la aparición de complicaciones, debido a que los factores de riesgo conocidos no explican toda la historia natural de las enfermedades. En este sentido el estudio de polimorfismos que ya ha demostrado ser importante en patología hepática, como el rs738409 del gen PNPLA3 y rs58542926 del gen TM6SF2, en una enfermedad tan importante como hepatitis crónica por VHC, se presenta como una necesidad para comprender mejor la evolución de enfermedad de nuestros pacientes y, eventualmente, servir como herramienta para seleccionar a quienes necesitan tratamiento con mayor urgencia, sobre todo hoy en día, en que existen drogas antivirales de acción directa altamente efectivas, pero que por sus costos no pueden ser aun ofrecidas de manera universal.
REFERENCIAS
1. Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence. Hepatology 2013;57:1333-42.
2. González R, Soza A, Hernández V, Pérez RM, Álvarez M, Morales A et al. Incidence and prevalence of hepatitis C virus infection in Chile. Ann Hepatol 2005;4:127-30.
3. Marcellin P. Hepatitis C: the clinical spectrum of the disease. J Hepatol 1999;31 Suppl 1:9-16.
4. Huang CF, Chuang WL, Yu ML. Chronic hepatitis C infection in the elderly. Kaohsiung J Med Sci 2011;27:533–7.
5. Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups. Lancet 1997;349:825–32.
6. Wright M, Goldin R, Fabre A, Lloyd J, Thomas H, Trepo C et al. Measurement and determinants of the natural history of liver fibrosis in hepatitis C virus infection: a cross sectional and longitudinal study. Gut 2003;52:574–9.
7. Missiha SB, Ostrowski M, Heathcote EJ. Disease progression in chronic hepatitis C: modifiable and nonmodifiable factors. Gastroenterology 2008;134:1699–714.
8. Patin E, Kutalik Z, Guergnon J, Bibert S, Nalpas B, Jouanguy E et al. Genome- wide association study identifies variants associated with progression of liver fibrosis from HCV infection. Gastroenterology 2012;143:1244–52.
9. Sanyal AJ. NASH: a global health problem. Hepatol Res 2011;41:670–4.
10. Romeo S, Kozlitina J, Xing C, Pertsemlidis A, Cox D, Pennacchio LA et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 2008;40:1461–5.
11. Anstee QM, Day CP. The genetics of NAFLD. Nat Rev Gastroenterol Hepatol 2013;10:645–55.
12. Dongiovanni P, Valenti L. Genetics of nonalcoholic fatty liver disease. Metabolism 2016;65:1026-37.
13. Trepo E, Pradat P, Potthoff A, Momozawa Y, Quertinmont E, Gustot T et al. Impact of patatin-like phospholipase-3 (rs738409 C>G) polymorphism on fibrosis progression and steatosis in chronic hepatitis C. Hepatology 2011;54:60–9.
14. Valenti L, Rumi M, Galmozzi E, Aghemo A, Del Menico B, De Nicola S et al. Patatin-like phospholipase domain-containing 3 I148M polymorphism, steatosis, and liver damage in chronic hepatitis C. Hepatology 2011;53:791–9.
15. Ampuero J, Del Campo JA, Rojas L, García-Lozano JR, Solá R, Andrade R et al. PNPLA3 rs738409 causes steatosis according to viral & IL28B genotypes in hepatitis C. Ann Hepatol 2014;13:356-63.
16. Nakamura M, Kanda T, Nakamoto S, Miyamura T, Jiang X, Wu S et al. No correlation between PNPLA3 rs738409 genotype and fatty liver and hepatic cirrhosis in Japanese patients with HCV. PLoS One 2013;8:e81312.
17. Fan JH, Xiang MQ, Li QL, Shi HT, Guo JJ. PNPLA3 rs738409 polymorphism associated with hepatic steatosis and advanced fibrosis in patients with chronic hepatitis c virus: a metaanalysis. Gut Liver 2016;10:456-63.
18. Dongiovanni P, Petta S, Maglio C, Fracanzani AL, Pipitone R, Mozzi E et al. Transmembrane 6 superfamily member 2 gene variant disentangles nonalcoholic steatohepatitis from cardiovascular disease. Hepatology. 2015;61:506-14.
19. Kozlitina J, Smagris E, Stender S, Nordestgaard B, Zhou H, Tybjærg-Hansen A et al. Exome-wide association study identifies a TM6SF2 variant that confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 2014;46:352–6.
20. Liu YL, Reeves HL, Burt AD, Tiniakos D, McPherson S, Leathart JB et al.TM6SF2 rs58542926 influences hepatic fibrosis progression in patients with non-alcoholic fatty liver disease. Nat Commun 2014;5:4309.
21. Coppola N, Rosa Z, Cirillo G, Stanzione M, Macera M, Boemio A et al. TM6SF2 E167K variant is associated with severe steatosis in chronic hepatitis C, regardless of PNPLA3 polymorphism. Liver Int 2015;35:1959-63.
22. Milano M, Aghemo A, Mancina RM, Fischer J, Dongiovanni P, De Nicola S et al. Transmembrane 6 superfamily member 2 gene E167K variant impacts on steatosis and liver damage in chronic hepatitis C patients. Hepatology 2015;62:111-7.
23. Petta S, Maida M, Grimaudo S, Pipitone RM, Macaluso FS, Cabibi D et al. TM6SF2 rs58542926 is not associated with steatosis and fibrosis in large cohort of patients with genotype 1 chronic hepatitis C. Liver Int 2016;36:198-204.
24. Sookoian S, Castaño GO, Scian R, Mallardi P, Fernández Gianotti T, Burgueño AL et al. Genetic variation in transmembrane 6 superfamily member 2 and the risk of nonalcoholic fatty liver disease and histological disease severity. Hepatology. 2015;61:515-25.
Correspondencia:
 BQ Mauricio Venegas Santos
BQ Mauricio Venegas Santos
 Sección Gastroenterología, HCUCH
Sección Gastroenterología, HCUCH
 [email protected]
[email protected]
 562 2978 8348
562 2978 8348