Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Serie guías clínicas: Diabetes y embarazo (2ª parte). Complicaciones crónicas y tratamiento en el embarazo
Rev Hosp Clin Univ Chile 2016; 27(1): 73-81
Hugo Maldonado E., Gloria López S., Jorge Hasbun H., Hugo Salinas P., Mauro Parra-Cordero, Enrique Valdés R.
OBJETIVOS DE LA GUÍA CLÍNICA
Objetivo principal
Entregar recomendaciones basadas en la mejor evidencia disponible para apoyar las decisiones clínicas de los profesionales responsables de la atención médica de mujeres embarazadas con diabetes para prevenir y/o reducir las complicaciones maternas y perinatales asociadas a esta condición.
Objetivos secundarios
Estandarizar la detección y el diagnóstico de diabetes en el embarazo.
Promover la planificación del embarazo en mujeres diabéticas en edad fértil.
Detectar signos y síntomas maternos y fetales que indicarían la interrupción del embarazo en forma anticipada.
Identificar los principales riesgos neonatales de los hijos de madre con diabetes y cómo minimizarlos.
Identificar los cuidados que la mujer diabética tiene durante el puerperio.
¿A QUIÉN VA DIRIGIDA LA PRESENTE GUÍA CLÍNICA?
La guía clínica va dirigida a matronas(es), estudiantes de Medicina, becarios/residentes de Ginecología y Obstetricia, becarios/residentes de Medicina Materno Fetal, obstetras que se desempeñan en hospitales de 3º nivel y especialista de Medicina Materno Fetal, con el fin de actualizar los conocimientos en el diagnóstico y manejo de gestaciones afectadas por diabetes.
NIVEL DE EVIDENCIA Y GRADO DE RECOMENDACIÓN
En la presente Guía Clínica se utilizará la clasificación de nivel de evidencia y grado de recomendación propuesta por Harbour et al (1).
Nivel de evidencia
1++: Metaanálisis de alta calidad, revisiones sistemáticas de ERC, o ERC con riesgo muy bajo de sesgo.
1+: Metaanálisis bien diseñados, revisiones sistemáticas de ERC, o ERC con riesgo bajo de sesgo.
1-: Metaanálisis, revisiones sistemáticas de ERC, o ERC con alto riesgo de sesgo.
2++: Revisiones sistemáticas de estudios casocontrol o cohorte de alta calidad, o estudios de caso-control o cohorte de alta calidad con riesgo muy bajo de factores confundentes o con alta probabilidad de que la relación sea causal.
2+: Caso-control o cohortes bien desarrollados con bajo riesgo de factores confundentes, y una probabilidad moderada de que la relación sea causal.
2-: Estudios caso-control o cohorte con alto riesgo de factores confundentes, y riesgo significativo de que la relación no sea causal.
3: Estudios no analíticos, por ejemplo, reporte de casos o serie de casos.
4: Opinión de expertos.
Grado de recomendación
A: Al menos un meta-análisis, revisión sistemática o ERC en categoría 1++, y directamente aplicable a la población objetivo, o
Una revisión sistemática de ERC o un nivel de evidencia consistente principalmente de estudios en categoría 1+ directamente aplicable a la población objetivo y demostrando consistencia global en los resultados.
B: Cantidad de evidencia que incluya estudios en categoría 2++ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 1++ o 1+.
C: Cantidad de evidencia que incluye estudios en categoría 2+ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados
o Evidencia extrapolada de estudios en categoría 2++.
D: Evidencia nivel 3 o 4, o
Evidencia extrapolada de estudios 2+
COMPLICACIONES CRÓNICAS
¿El embarazo es un factor de riesgo de complicaciones maternas microvasculares? Retinopatía en la mujer con DPG :
• Realizar un examen de fondo de ojo en el primer trimestre a toda mujer diabética que se embaraza. (A)
• Si el examen es normal o presenta retinopatía diabética (RD) no proliferativa, se recomienda control cada 3 meses por oftalmólogo. Si presenta RD no proliferativa severa control mensual. (C)
• Se recomienda panfotocoagulación con láser por especialista al más mínimo brote de neovascularización. (A)
El embarazo es un factor de riesgo para la progresión de la RD. La severidad de la retinopatía al momento de la concepción es el factor más importante de la progresión durante el embarazo. The Diabetes in early Pregnancy Study realizó un estudio prospectivo que siguió a una cohorte de 140 mujeres con DM1 sin retinopatía proliferativa de base desde el período periconcepcional hasta un mes post parto. Encontró que la progresión de la retinopatía está en función del daño inicial: 10% en las que no tenían retinopatía, 21% en las que tenían una retinopatía leve y en 29% de las mujeres con RD no proliferativa moderada a severa al momento de la concepción. El aumento del riesgo podría deberse tanto al mal control metabólico inicial, con niveles de HbA1C ≥ 6%, como a la corrección rápida del control metabólico en el período inicial del embarazo. La retinopatía no es contraindicación para el parto vaginal(2) [2].
¿Cuál es el efecto del embarazo en la función renal y en la progresión de la nefropatía diabética?
• En toda mujer embarazada con el antecedente de proteinuria antes del embarazo o en quien se sospeche PE, detectar y cuantificar proteinuria. (C)
• Se recomienda utilizar niveles de albúmina entre 30-299 mg/día persistente para indicar microalbuminuria o nefropatía incipiente, niveles mayores a 300 mg/día indican macroalbuminuria y presencia de nefropatía. (C)
• Se recomienda optimizar el control glicémico y de la presión arterial en mujeres embarazadas con nefropatía diabética para reducir el riesgo o retardar la progresión de la nefropatía diabética. (A)
Los cambios de la función renal se pueden evaluar con una correcta interpretación del nivel de creatinina sérica. La concentración de creatinina disminuye a menos de 0,9 mg/dl, hasta valores de 0,4 y 0,6 mg/dl en una paciente con embarazo normal. En valor de creatinina de 1 mg/dl que puede ser normal en mujeres no embarazadas puede reflejar un importante deterioro de la función renal durante la gestación. El diagnóstico de nefropatía diabética se basa en la presencia de proteína en orina, proteinuria o albuminuria mayor 300 mg/día antes del embarazo o en las primeras 20 semanas de embarazo en ausencia de infección urinaria. Un valor mayor de 3 gramos/día se considera rango nefrótico. El método más utilizado y seguro para cuantificar la albúmina en orina es la razón albuminuria/creatinuria (RAC) en una muestra aislada de orina, ya que tiene buena correlación con la medición de proteína en 24 horas(3) [4].
TRATAMIENTO
¿Qué tratamiento es el más indicado para pacientes con DPG y DG ?
• Toda mujer con DM1 requiere tratamiento con insulina. Utilizar insulinas humanas convencionales, NPH e insulina rápida o alternativamente análogos de acción rápida lispro y aspártica. (A)
• Las mujeres con DM2 que no logran las metas de glicemia con el tratamiento médico nutricional deben ser manejadas con insulina NPH más insulina de acción rápida, si fuera necesario. (A)
• Utilizar un esquema de tratamiento intensificado con múltiples dosis de insulina y automonitoreo para lograr las metas de control glicémico en mujeres con DM tipo 1 y tipo 2 durante el embarazo. (A)
• No se debe iniciar tratamiento con hipoglicemiantes orales (HO) durante el embarazo. Aquellas mujeres que se embarazan mientras están en tratamiento con metformina continuar el tratamiento hasta la semana 13 y luego reemplazar por insulina. (C)
• Utilizar HO (metformina y glibenclamida) en mujeres con DG refractarias al tratamiento con cambios en el estilo de vida solo bajo protocolos de investigación. (C)
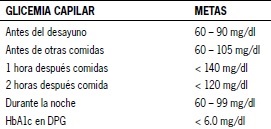
Tabla 1. Metas de control glicémico durante el embarazo
¿Cuál es el objetivo del tratamiento de la mujer embarazada con DPG?
El tratamiento médico de la DPG es el monitoreo de los niveles de glicemia con ajustes en la dieta y el tratamiento con insulina para lograr normoglicemia. El mantener niveles de glicemia maternos normales o muy cercanos a la normalidad reduce la probabilidad de efectos adversos en el embarazo, como aborto, anomalías congénitas, macrosomía y mortinatos. Idealmente se debe lograr normoglicemia antes de la concepción y mantenerla hasta el puerperio(4).
Los niveles óptimos de glicemia en sangre capilar durante el embarazo según distintas organizaciones (ej. ACOG, ADA), son muy parecidos entre ellos y están basadas en la opinión de expertos. En Chile, el consenso es mantener niveles de glicemia en ayunas entre 60 y 90 mg/dl y bajo < 140 mg/dl, 1 hora post prandial [4].
¿El tratamiento de la DG reduce las complicaciones?
Uno de los estudios más importantes es el ensayo clínico Australian Carbohydrate Intolerance Study in Pregnant Women (ACHOIS), que hizo una asignación aleatoria de mujeres con 24 a 34 semanas de embarazo y el diagnóstico de DG, a un grupo de intervención que recibió consejería dietética, monitoreo de glicemia y tratamiento con insulina cuando fue necesario y comparó los resultados con el grupo que recibió cuidados habituales. Los resultados primarios incluyeron cualquier complicación perinatal grave (definidas como muerte, distocia de hombro, fracturas y parálisis cerebral), admisión a unidades de cuidados intensivos neonatales, inducción del parto, cesárea y depresión. Los resultados mostraron que el tratamiento de la DG reduce la morbilidad perinatal grave y puede mejorar la calidad de vida de la mujer(5) [1].
TRATAMIENTO FARMACOLÓGICO
a) Insulinoterapia:
En nuestro país, y según opinión de los especialistas, se recomienda el uso de insulina NPH durante el embarazo, como ha sido la costumbre hasta ahora. Su seguridad y efectividad en el embarazo está demostrada en la literatura a través de varias décadas. Tiene la gran ventaja de que las dosis pueden ser ajustadas en forma rápida y con la frecuencia que sea necesaria en respuesta a una ingesta calórica variable o cambios en la sensibilidad a la insulina en estas mujeres(6).
No se considera que los datos disponibles sean lo suficientemente contundentes para recomendar el uso rutinario de análogos de insulina (detemir) en lugar de NPH durante la gestación. No obstante, si una paciente está en tratamiento con insulina detemir antes del embarazo y tiene un buen control metabólico, parece razonable continuar con el mismo tratamiento.
Análogos de acción rápida: Lispro y aspártica son seguras y útiles durante el embarazo (FDA C).
Análogos de acción prolongada: Glargina (Lantus ®) no ha sido aprobada por la FDA ni EMEA en el embarazo; sin embargo, dado que muchas mujeres con DM1 están bien controladas con glargina y el cambio a NPH pudiese tomar un tiempo precioso hasta lograr un buen control metabólico, se aconseja discutirlo con la paciente. La otra insulina
análoga de acción prolongada, la detemir (Levemir ®) fue aprobada para su uso en el embarazo, pero no hay suficiente tiempo de uso para conocer su real utilidad. Por el momento, cuando la NPH (habitualmente en DM1) no logra el control por muchas hipoglicemias u horarios de alimentación erráticos, sería correcto indicar detemir(7) [4].
b) Hipoglicemiantes orales y drogas insulinosensibilizantes:
En la última década se ha acumulado evidencia científica que pretende revalidar el uso de agentes hipoglicemiantes orales (HGO) durante el embarazo en gestantes que sufren patologías relacionadas a la alteración del metabolismo de los hidratos de carbono. La indicación de metformina y glibenclamida en embarazadas portadoras de DG insulinorequirentes presenta diferentes grados de eficacia en alcanzar los objetivos metabólicos.
• Las gestantes portadoras de DM2 y que están siendo tratadas inicialmente con metformina o glibenclamida se les debe informar que estos fármacos al parecer no incrementarían el riesgo de malformaciones ni de abortos espontáneos. (C)
Glibenclamida
En los últimos años se ha recopilado información que avalaría que el uso de glibenclamida (sulfonilurea de segunda generación) durante el embarazo, sería seguro y eficaz como la insulinoterapia en el control de las hiperglicemias de pacientes portadoras de DG, refractarias a la restricción calórica(8). Es así que un estudio metodológicamente apto demostró que no existían diferencias significativas entre las glicemias y la concentración de hemoglobina glicosilada de aquellas gestantes tratadas con el hipoglicemiante oral o con insulina, presentando un fracaso de sólo 4%. [1+].
Desde ese momento se publicaron diversos artículos que permitieron acumular evidencia acerca de esta indicación versus insulinoterapias en el manejo de la DM gestacional insulinorequirente (DGI) que se pueden concentrar en una revisión sistemática que incorpora a los tres estudios metodológicamente más valorados, el cual concluye(9): [1]
a) Falta de diferencias significativas en el control metabólico entre ambos grupos, incluyendo glicemias en ayunas y post prandiales (2 horas).
b) Incidencia similar de operaciones cesáreas (rango 23 – 52%).
c) Ausencia de diferencias significativas en el peso de los RN.
En contraste a estas conclusiones auspiciosas, recientemente se publicó que la incidencia de hipoglicemia neonatal fue dramáticamente mayor en las madres usuarias de glibenclamida (33% versus 4%)(10) [2 ++].
El mayor problema que se le atribuye a la glibenclamida es la ocurrencia de hipoglicemia, las que son propias de todas las sulfonilureas con una frecuencia que fluctúa entre 1 a 5%, lo anterior sumado a los efectos adversos presentes entre el 3,2% y 4,1% de las pacientes tratadas (naúseas, vómitos, etc) [2++].
A pesar de lo anteriormente expuesto, es importante destacar que el paso a través de la leche materna de la glibenclamida es escaso y no se han evidenciado hipoglicemias en el lactante. [2 ++](11).
Metformina
Por otra parte, el uso de metformina (biguanida de segunda generación) ha demostrado ser seguro durante el embarazo que a pesar de cruzar libremente la placenta no ha demostrado tener un efecto importante en el transporte de glucosa fetal y su indicación no ha sido asociada a abortos ni efectos teratogénicos e hipoglicemias neonatales [2+].
Una de las indicaciones de esta biguinida es en pacientes con síndrome de ovario poliquístico (SOP) debido a su alta asociación con síndrome de insulinorresistencia (SIR). En estas pacientes de restringida fertilidad, la metformina comparada con sus respectivos controles, no sólo mejoró los índices de concepción, sino que disminuyó la tasa de abortos espontáneos (17% versus 62%)(12) [2+]. Sin embargo, en forma inesperada se presentó mayor cantidad de partos prematuros en el grupo tratado con metformina.
Como tratamiento alternativo a la insulinoterapia en DG refractaria a la dietoterapia y actividad física, los estudios han demostrado que la indicación de metformina logró un adecuado control metabólico sin presentar en la madre efectos adversos grave (hipoglicemia y acidosis láctica).
El estudio de mejor diseño metodológico en que se comparó la efectividad y seguridad de la metformina con la insulina en pacientes portadoras de DG insulinorequirentes, incluyó a 751 pacientes, las que fueron randomizadas entre las 20 y 33 semanas. El fracaso en alcanzar los objetivos metabólicos de las usuarias de metformina fue de 7,4%. En aquellas gestantes manejadas exitosamente no presentaron diferencias significativas en las concentraciones de glicemias en ayunas; sin embargo, obtuvieron valores menores de glicemias post prandiales medidas a las 2 horas [2+]. La incidencia de preeclampsia fue similar en ambos grupos. A pesar de estos resultados, la suplementación insulínica fue necesaria en el 46.3%; suspensión de metformina por sintomatología gastrointestinal (1.9%) y por alteración de pruebas hepáticas y/o complicaciones obstétricas (2.9%); prematuridad (mayor en grupo metformina [12.1% v/s 7.6%; p=0,04] y además se ha asociado a acidosis láctica y PE.
Por último, el único ensayo clínico donde se evaluó el uso de metformina versus placebo durante el embarazo en pacientes SOP no demostró que dicha indicación profiláctica durante el embarazo previniera la DG, preeclampsia ni RCF(13).
Es importante destacar que los neonatos asignados a metformina no sólo presentaron menor tasa de hipoglicemias (3,3% versus 8,1% p=0,008), sino que también la proporción de traumatismos, distocia de hombros, Apgar a los 5 minutos menor de 7 y admisión a Unidades de Cuidados Intensivos también fueron menores(12) [2++].
Buena práctica clínica
Basándose en la evidencia acumulada y siendo consecuente con la fisiopatología de la DG, se sugiere que la droga alternativa o complementaria a utilizar a la insulinoterapia es la metformina. El uso de glibenclamida aún debe ser restringida a gestantes incluidas en protocolos de investigación en vías de alcanzar conclusiones metodológicamente válidas que permitan avalar su utilización. Cabe destacar que la eventual indicación de estos HO debe ser evaluada por equipo médico interdisciplinario según las características clínicas de cada paciente.
Por otra parte, en gestantes con antecedente de SRI pregestacional, se sugiere que la metformina debe ser continuada a dosis de 1000 mg/día (500 mg c 12 horas), discontinuando su uso a partir de las 13 semanas. Esta misma dosificación es la sugerida en pacientes con indicación complementaria a la insulinoterapia en pacientes portadoras de DG refractarias a indicaciones nutricionales y actividad física.
CUIDADOS NEONATALES
¿Cuáles son los riesgos de los hijos de madre diabética y como minimizarlos?
Existe una mayor frecuencia de complicaciones neonatales en los hijos de mujeres que cursan embarazos con diabetes, ya sea DG o DPG. De ahí la importancia de reconocimiento precoz de la patología para mejorar su manejo. Los resultados están directamente relacionados con el inicio y la duración de la intolerancia a la glucosa durante el embarazo y la gravedad de la diabetes de la madre. Es así como los hijos de madres con DPG tienen mayor riesgo de enfermedades congénitas y mortalidad perinatal, mientras que los hijos de madres con DG tienen mayor riesgo de macrosomía e hipoglicemia neonatal.
Adicionalmente, la obesidad en forma independiente del estatus de la diabetes, contribuye al desarrollo de macrosomía y puede contrarrestar los beneficios de un buen control glicémico en estas mujeres(14).
Mortalidad perinatal: asociadas a malformaciones congénitas y complicaciones durante el trabajo de parto. El riesgo de muerte fetal tardía y neonatal aumenta a mayor índice de masa corporal.
Anomalías congénitas: el riesgo de malformaciones congénitas en los hijos de madres diabéticas se considera al menos 10 veces mayor que en la población general. Entre 4 a 6% de los hijos de madres diabéticas tienen una o más malformaciones congénitas mayores. Dentro de las más frecuentes se encuentran las cardíacas, músculo–esqueléticas y del tejido conectivo(15).
Hipoxia – isquemia prenatal e intraparto: hay estudios que evidencian que los hijos de madres diabéticas son más hipóxicos y que los niveles de HbA1c materna durante el último mes de embarazo se correlacionan con la mayor eritropoyesis fetal, reflejando que el control de la glicemia materna tiene una correlación con el riesgo de hipoxia fetal(16).
Macrosomía y traumatismo del parto: es la principal complicación de las mujeres con DG [1]. Se define macrosomía como el peso del RN por sobre los 4.000 o 4.500 gr (dependiendo del estudio). No considera la edad gestacional ni tampoco su potencial genético, por lo que en muchas ocasiones también se incluye su fenotipo para caracterizarlo(17).
Hipoglicemia y otras alteraciones metabólicas: secundario a la persistencia del hiperinsulinismo fetal después del parto y asociado a un insuficiente o ausente aporte glicémico, se puede presentar hipoglicemia en grado variable. Otra causa de hipoglicemia se relaciona a la presencia de hiperglicemia materna durante el trabajo de parto, que igualmente estimula la secreción excesiva de insulina fetal incluso 1 ó 2 horas post parto(18).
PUERPERIO Y CUIDADOS A MEDIANO PLAZO
¿Cuál es el riesgo de desarrollar DM tipo 2 luego del diagnóstico DG?
El diagnóstico de DG implica una mayor probabilidad de mantener un estado hiperglicémico después de finalizado el embarazo, con el consecuente aumento del riesgo cardiovascular. El riesgo de desarrollar DM2 varía entre 2,6 a 70% dependiendo del criterio diagnóstico utilizado, edad, etnia, IMC y tiempo de seguimiento del estudio [1]. Un metaanálisis que incluyó 20 estudios de cohorte reportó que las mujeres con DG tienen 7,43 (RR: IC 95% 4,79 – 11,51) veces más riesgo de desarrollar DM2 comparado con mujeres que cursan embarazos normoglicémicos [1].
El riesgo es mayor los primeros 5 años [1], siendo la mujer latinoamericana una de las más afectadas con cifras reportadas de 47% en dicho período(19) [2].
¿Se justifica realizar tamizaje post parto de mujeres con DG?
En Chile, la prevalencia de DM2 en la población femenina es de 10,4% (2010). Con esta alta prevalencia es lógico pensar que en mujeres chilenas con DG esta cifra es aún mayor. Por otra parte, algunos reportes de la literatura indican que el 60% de los diabéticos se diagnostica en etapa preclínica, cifra que aumenta a 88% cuando se analizan las mujeres con antecedentes de DG(20) [2]. Esto junto la existencia de una intervención efectiva que cambia el curso de la enfermedad como se ha tratado en los párrafos anteriores, sustenta ampliamente el tamizaje selectivo de DM2 en mujeres chilenas con DG.
REFERENCIAS
1. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001;323:334-6.
2. Chew EY, Mills JL, Metzger BE, Remaley NA, Jovanovic-Peterson L, Knopp RH et al. Metabolic control and progression of retinopathy. The Diabetes in Early Pregnancy Study. National Institute of Child Health and Human Development Diabetes in Early Pregnancy Study. Diabetes Care 1995;18:631–7.
3. Gobierno de Chile. Ministerio de Salud 2010. Guía Clínica Prevención Enfermedad Renal Crónica. Hallado en: https://goo.gl/vDGMyC
4. Schaefer UM, Songster G, Xiang A, Berkowitz K, Buchanan TA, Kjos SL. Congenital malformations in offspring of women with hyperglycemia first detected during pregnancy. Am J Obstet Gynecol 1997;177:1165–71.
5. Ehrlich SF, Crites YM, Hedderson MM, Darbinian JA, Ferrara A. The risk of large for gestational age across increasing categories of pregnancy glycemia. Am J Obstet Gynecol 2011;204:240.e1–240.e6.
6. Jovanovic L1, Knopp RH, Brown Z, Conley MR, Park E, Mills JL et al. Declining insulin requirement in the late first trimester of diabetic pregnancy. Diabetes Care 2001;24:1130–6.
7. Mukhopadhyay A, Farrell T, Fraser RB, Ola B. Continuous subcutaneous insulin infusion vs intensive conventional insulin therapy in pregnant diabetic women: a systematic review and metaanalysis of randomized, controlled trials. Am J Obstet Gynecol 2007;197:447–56.
8. Langer O, Conway DL, Berkus MD, Xenakis EM, Gonzales O. A comparison of glyburide and insulin in women with gestational diabetes mellitus. N Engl J Med 2000;343:1134–8.
9. Nicholson W, Bolen S, Witkop CT, Neale D, Wilson L, Bass E. Benefits and risks of oral diabetes agents compared with insulin in women with gestational diabetes: a systematic review. Obstet Gynecol 2009;113:193–205.
10. Bertini AM, Silva JC, Taborda W, Becker F, Lemos Bebber FR, Zucco Viesijm JM et al. Perinatal outcomes and the use of oral hypoglycemic agents. J Perinat Med 2005;33:519–23.
11. Refuerzo JS. Oral hypoglycemic agents in pregnancy. Obstet Gynecol Clin North Am 2011;38:227–34.
12. Rowan JA, Hague WM, Gao W, Battin MR, Moore MP. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med 2008;358:2003–15.
13. Glueck CJ, Wang P, Goldenberg N, Sieve-Smith L. Pregnancy outcomes among women with polycystic ovary syndrome treated with metformin. Hum Reprod 2002;17:2858–64.
14. Vanky E, Stridsklev S, Heimstad R, Romundstad R, Skogøy K, Kleggetveit O et al. Metformin versus placebo from first trimester to delivery in polycystic ovary syndrome: a randomized, controlled multicenter study. J Clin Endocrinol Metab 2010;95:E448–E455.
15. Hillier TA, Pedula KL, Vesco KK, Schmidt MM, Mullen JA, LeBlanc ES et al. Excess gestational weight gain: modifying fetal macrosomia risk associated with maternal glucose. Obstet Gynecol 2008;112:1007–14.
16. Mitanchez D. Foetal and neonatal complications in gestational diabetes: perinatal mortality, congenital malformations, macrosomia, shoulder dystocia, birth injuries, neonatal complications. Diabetes Metab 2010;36(6 Pt2):617–27.
17. Mitanchez D. Management of infants born to mothers with gestational diabetes. Paediatric environment. Diabetes Metab 2010;36(6 Pt 2):587–94.
18. The Confidential Enquiry into Maternal and Child Health (CEMACH). Diabetes in pregnancy: caring for the baby after birth. Findings of a National Enquiry: England, Wales and Northern Ireland. CEMACH: London; 2007.
19. Kjos SL, Peters RK, Xiang A, Henry OA, Montoro M, Buchanan TA. Predicting future diabetes in Latino women with gestational diabetes. Utility of early postpartum glucose tolerance testing. Diabetes 1995;44:586–91.
20. Mohamed N, Dooley J. Gestational diabetes and subsequent development of NIDDM in aboriginal women of northwestern Ontario. Int J Circumpolar Health 1998;57 Suppl 1:355-8
Correspondencia:
 Dr. Enrique Valdés Rubio
Dr. Enrique Valdés Rubio
 Unidad de Medicina Fetal
Unidad de Medicina Fetal
 [email protected]
[email protected]
 562 2978 8881 - 562 2978 8880
562 2978 8881 - 562 2978 8880