Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Guía clínica. Diabetes y embarazo: Cuidado preconcepcional, diagnóstico y seguimiento
Rev Hosp Clin Univ Chile 2015; 26(4): 348-58.
Hugo Maldonado E., Gloria López S., Jorge Hasbun H., Hugo Salinas P., Mauro Parra-Cordero, Enrique Valdés R.
Objetivo principal
Entregar recomendaciones basadas en la mejor evidencia disponible para apoyar las decisiones clínicas de los profesionales responsables de la atención médica de mujeres embarazadas con diabetes para prevenir y/o reducir las complicaciones maternas y perinatales asociadas a esta condición.
Objetivos secundarios
• Estandarizar la detección y el diagnóstico de diabetes en el embarazo.
• Promover la planificación del embarazo en mujeres diabéticas en edad fértil.
• Detectar signos y síntomas maternos y fetales que indicarían la interrupción del embarazo en forma anticipada.
• Identificar los principales riesgos neonatales de los hijos de madre con diabetes y cómo minimizarlos.
• Identificar los cuidados que la mujer diabética tiene durante el puerperio.
¿A QUIÉN VA DIRIGIDA LA PRESENTE GUÍA CLÍNICA?
La guía clínica va dirigida a matronas(es), estudiantes de medicina, becarios/residentes de Ginecología y Obstetricia, becarios/residentes de Medicina Materno-fetal, obstetras que se desempeñan en hospitales de 3º nivel y especialista de Medicina Materno-fetal, con el fin de actualizar los conocimientos en el diagnóstico y manejo de gestaciones afectadas por diabetes.
NIVEL DE EVIDENCIA Y GRADO DE RECOMENDACIÓN
En la presente guía clínica se utilizará la clasificación de nivel de evidencia y grado de recomendación propuesta por Harbour et al(1).
Nivel de evidencia
1++: Metaanálisis de alta calidad, revisiones sistemáticas de ERC, o ERC con riesgo muy bajo de sesgo.
1+: Metaanálisis bien diseñados, revisiones sistemáticas de ERC, o ERC con riesgo bajo de sesgo.
1-: Metaanálisis, revisiones sistemáticas de ERC, o ERC con alto riesgo de sesgo.
2++: Revisiones sistemáticas de estudios caso-control o cohorte de alta calidad, o estudios de casocontrol o cohorte de alta calidad con riesgo muy bajo de factores confundentes o con alta probabilidad de que la relación sea causal.
2+: Caso-control o cohortes bien desarrollados con bajo riesgo de factores confundentes, y una probabilidad moderada de que la relación sea causal.
2-: Estudios caso-control o cohorte con alto riesgo de factores confundentes, y riesgo significativo de que la relación no sea causal.
3: Estudios no analíticos, por ejemplo, reporte de casos o serie de casos.
4: Opinión de expertos.
Grado de recomendación
A: Al menos un metaanálisis, revisión sistemática o ERC en categoría 1++, y directamente aplicable a la población objetivo, o
Una revisión sistemática de ERC o un nivel de evidencia consistente principalmente de estudios en categoría 1+ directamente aplicable a la población objetivo y demostrando consistencia global en los resultados.
B: Cantidad de evidencia que incluya estudios en categoría 2++ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 1++ o 1+.
C: Cantidad de evidencia que incluye estudios en categoría 2+ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados, o
Evidencia extrapolada de estudios en categoría 2++.
D: Evidencia nivel 3 o 4, o
Evidencia extrapolada de estudios 2+.
INTRODUCCIÓN
Diabetes pregestacional (DPG)
La epidemia global de la diabetes mellitus tipo 2 (DM2), como fue declarada por la OMS(2), afecta a más de 2% de la población mundial, teniendo las pacientes al momento del diagnóstico edades más precoces. Además, ha desplazado a la DM tipo 1 (DM1) durante la última década, como predominante en la DPG.
La hiperglicemia al momento de la concepción aumenta el riesgo de malformaciones fetales durante el primer trimestre del embarazo. En un metaanálisis que incluyó a 1.877 mujeres con DPG, DM1 y 2, de siete cohortes en Finlandia y EEUU, la tasa de malformaciones congénitas fue de 5,9%. De éstas, 36,8% fueron cardíacas y 20,8% neurológicas(3). El mismo estudio demostró que existe una correlación altamente significativa entre el riesgo absoluto de malformaciones congénitas y el nivel de HbA1c periconcepcional; niveles >10% se asocian a una tasa de 50% de malformaciones congénitas. Por el contrario, con niveles de HbA1c bajo 7,0% esta tasa tiende a cero [1+].
Por otra parte, el mal control metabólico se asocia a una mayor tasa de complicaciones. Entre las complicaciones se describe una mayor incidencia de hipertensión (40 a 45%), con una mayor frecuencia de preeclampsia en las mujeres con DM1 y de hipertensión crónica en las con DM2. La muerte fetal en útero, tanto en la mujer con DM1 como en la DM2, ocurre en el tercer trimestre y se relaciona con insuficiencia placentaria precoz: la tasa de 12 por mil en el 2003 ha aumentado a 29,2
por mil en el 2007(4).
Diabetes gestacional (DG)
Datos procedentes de Inglaterra y Gales indican que entre 2 y 5% del total de partos corresponden a embarazos complicados con diabetes. La gran mayoría, 87,5% son DG. Dependiendo de los criterios diagnósticos y la población estudiada, la prevalencia de DG varía entre 1,1% a 25,5%(5). La International Association of Diabetes and Pregnancy Study Groups (IADPSG) reporta una prevalencia de 17,8% que se basa en los resultados del estudio Hyperglycemia and Adverse Pregnancy Outcomes (HAPO), una cohorte de aproximadamente 25.000 mujeres de distintos países y culturas(5).
Con el aumento de la obesidad y el hábito sedentario, la prevalencia de diabetes entre las mujeres en edad fértil está aumentando a nivel global. La prevalencia de la DG está en directa proporción con la prevalencia de la DM2 en una determinada población. El riesgo de DG aumenta en mujeres según categoría de sobrepeso, con un OR de 3,5; 7,7 y 11 en mujeres con sobrepeso (IMC 25 a 29,9), obesidad (IMC 30-34,9) y obesidad mórbida (IMC >ó=35), respectivamente(6). La DG no solamente produce efectos durante el embarazo concurrente, sino que además determina un riesgo de progresión a DM tipo 2(7).
Definición de términos a utilizar en la presente guía:
• Diabetes pregestacional: el término se refiere a una mujer con el diagnóstico de DM1 o 2, conocida antes del embarazo. El diagnóstico se hace utilizando los criterios definidos por la OMS(8) para la población general en cualquiera de las siguientes situaciones:
1. Síntomas clásicos de diabetes y una glicemia en cualquier momento del día mayor o igual a 200 mg/dl, sin relación con el tiempo transcurrido desde la última comida.
2. Glicemia en ayunas en plasma venoso mayor o igual a 126 mg/dl. Debe confirmarse con un segundo examen realizado en el laboratorio en un día diferente.
3. Glicemia mayor o igual a 200 mg/dl dos horas después de una carga de 75 gr de glucosa durante una PTGO.
4. HbA1c ≥ 6,5%, criterio de diagnóstico aceptado internacionalmente sólo en aquellos casos en que el examen esté certificado por el National Glycohemoglobin Standarization Program(9).
• Diabetes gestacional: la definición clásica ha sido cualquier grado de intolerancia a la glucosa, cuya severidad es inferior a los valores diagnósticos de diabetes, que se manifiesta o se detecta durante el embarazo. Aun cuando la mayoría de los casos se resuelve con el parto, la definición es aplicable incluso en aquellos casos en que la condición persiste después del embarazo. Tampoco excluye la posibilidad de que la intolerancia pudiera haber precedido o haberse iniciado concomitante con el embarazo. Según lo anterior se dan las siguientes situaciones:
1. Glicemia alterada en ayunas (GAA): glicemia en ayunas ≥ 100 mg/dl y menor que 126 mg/dl, en 2 días diferentes y/o
2. Intolerancia a la glucosa oral (IGO): glicemia en ayunas ≥ 100 mg/dl y/o glicemia a las 2 horas postcarga entre 140-199 mg/dl.
TAMIZAJE Y DIAGNÓSTICO
¿A qué mujeres se les debe hacer tamizaje de DM durante el embarazo y en qué momento? ¿Cuáles son los criterios de diagnóstico de DG y DPG?
• Realizar tamizaje universal, con un examen de glicemia en ayunas, a toda mujer en el primer control prenatal. (C)
• Realizar una prueba de tolerancia oral a la glucosa (PTGO) a las 24 – 28 semanas para detectar DG a toda mujer con una glicemia normal en el primer trimestre del embarazo. (A)
• Realizar una segunda PTGO a las 30 – 33 semanas a toda mujer con factores de riesgo de DG. (C)
No existe acuerdo sobre cuál es la metodología más adecuada para hacer tamizaje y diagnóstico de la DG. Desde que la DG fue establecida como una entidad clínica el año 1964, se han sucedido más de una decena de métodos de tamizaje y diagnóstico. Se basan en un método de uno o dos pasos con una prueba con una carga de glucosa variable y criterios también variables en el umbral para considerar la glicemia alterada. Al no existir un estándar de oro universalmente aceptado para el diagnóstico de DG, diversos criterios han sido utilizados por distintas organizaciones(10).
Chile junto con otros países ha decidido no adoptar el criterio diagnóstico de la IADPSG-2010 adoptada por la ADA 2011 y WHO 2013, con el siguiente fundamento: su adopción podría aumentar la prevalencia de DG en 2 – 8 veces. En países con alta prevalencia de DG, como Chile, esto podría significar que el 80% de las mujeres embarazadas fueron clasificadas como diabéticas gestacionales, sin serlo realmente.
El mencionado criterio se basa en el nivel de glicemia y no toma en consideración otros factores de riesgo como obesidad e hipertrigliceridemia, que influyen tanto o más que la hiperglicemia en la macrosomia u otras complicaciones. La adopción de este criterio diagnóstico no sería costo-efectivo(11,12).
Ante la falta de consenso, en nuestro país el grupo de trabajo acordó los siguientes criterios para hacer tamizaje y diagnóstico de diabetes en el embarazo (Figura 1):
Figura 1. Algoritmo diagnóstico de diabetes en el embarazo
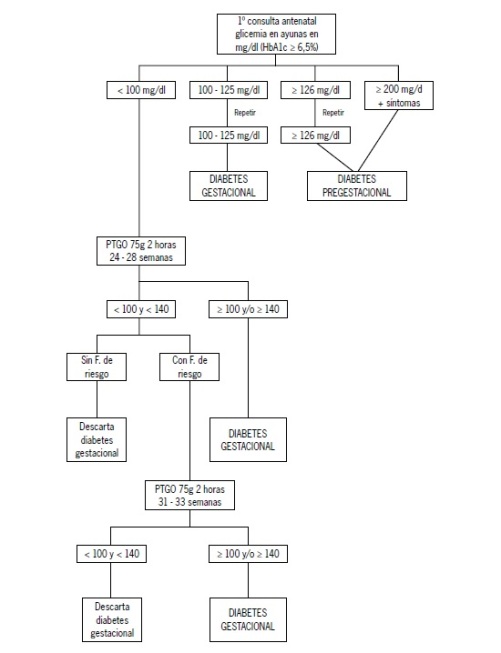
A: Realizar tamizaje universal con un examen de glicemia en ayunas a toda mujer embarazada en el primer control prenatal (primer trimestre).
B: El diagnóstico de DM durante el primer trimestre del embarazo se basa en los mismos criterios que se utilizan para la población general:
• Síntomas clásicos de diabetes y una glicemia en cualquier momento del día mayor o igual a 200 mg/dl, sin relación con el tiempo transcurrido desde la última comida.
• Glicemia en ayunas ≥ 126 mg/dl. Confirmar con una segunda glicemia ≥ 126 mg/dl en un día diferente.
• Glicemia ≥a 200 mg/dl dos horas después de una carga de 75 gr de glucosa durante una PTGO.
• HbA1c mayor 6,5%.
C: Si el resultado del examen de tamizaje muestra una glicemia entre 100 y 125 mg/dl (glicemia alterada en ayunas – GAA) considerar las siguientes alternativas:
• GAA + 2 o más factores de riesgo de DG: realizar PTGO.
• Resultado PTGO: Si la GAA es mayor 100 mg/dl y/o glicemia a las 2 horas post – carga es igual o mayor 140-199 mg/dl (intolerancia a la
glucosa – IGO), diagnostica DG.
Si la glicemia a las 2 horas postcarga es ≥ 200 mg/dl diagnosticar DM o DPG.
• GAA y menos de 2 factores de riesgo de DG: realizar una segunda glicemia en ayunas dentro de un plazo máximo de siete días. Si persiste un nivel de glicemia entre 100 y 125 mg/dl, se hará el diagnóstico de DG.
D: Realizar una PTGO a las 24-28 semanas a toda mujer con una glicemia normal en el primer trimestre.
Si la glicemia en ayunas es inferior a 100 mg/dl y a las 2 horas postcarga inferior a 140 mg/dl, se descarta el diagnóstico de DG. Si la glicemia en ayunas es inferior a 100 mg/dl y a las 2 horas post carga inferior a 140 mg/dl, pero la paciente tiene al menos dos factores de riesgo para el desarrollo de DG, repetir la prueba entre la semana 30 y 33. Si la glicemia en ayunas está entre 100 y 125 mg/dl y/o la glicemia a las 2 horas post carga es entre 140 – 199 mg/dl (IGO), se diagnostica DG.
E: Repetir la PTGO a las 30 – 33 semanas a toda mujer con factores de riesgo de DG y con glicemias normales en la PTGO realizada en el segundo trimestre.
Si la glicemia en ayunas es inferior a 100 mg/dl y a las 2 horas postcarga inferior a 140 g/dl, se descarta el diagnóstico de DG. Si la glicemia en ayunas está entre 100-125 mg/dl y/o la glicemia a las 2 horas postcarga es entre 140 – 199 mg/dl (IGO), se diagnostica DG.
Se sugiere realizar PTGO precozmente (11 – 14 semanas) en aquellas pacientes en que se requiere confirmar DG, dado presencia de factores de riesgo, a pesar de no ser una prueba con valores tan categóricos en esta etapa de la gestación.
CUIDADO PRECONCEPCIONAL
¿Es relevante el cuidado preconcepcional en pacientes con DPG?
• En mujeres con antecedente de DPG se recomienda un control metabólico óptimo para disminuir el riesgo de malformaciones congénitas. (B)
• Se recomienda que toda paciente con DPG realice un control metabólico preconcepcional adecuado para disminuir la incidencia de abortos espontáneos y condiciones patológicas asociadas al embarazo. (B)
• En la paciente portadora de diabetes mellitus 1 ó 2 se recomienda el adecuado control preconcepcional realizado por un equipo multidisciplinario. (C)
El cuidado preconcepcional es reconocido como un componente crítico en la atención sanitaria de las mujeres en edad reproductiva. El mismo se define como un conjunto de intervenciones que se realizan antes del embarazo que tienen como propósito identificar y modificar factores de riesgo, cuando sea posible, para reducir daños o evitarlos en un próximo embarazo(13).
Es recomendable que toda mujer en edad fértil, con DM 1 y 2, planifique su embarazo. El objetivo terapéutico primario es lograr que la mujer que se embaraza lo haga con niveles normales de glucosa (idealmente HbA1c menro que 6,5%) y los mantenga durante todo el período preconcepcional. De lo contrario, aumenta el riesgo de muerte materna y fetal, prematuridad, macrosomía y malformaciones fetales [1].
Una revisión sistemática para evaluar la efectividad y seguridad del cuidado preconcepcional en mejorar los resultados maternos y fetales en
mujeres con DM1-2, mostró que este cuidado es efectivo en: reducir las malformaciones congénitas asociadas a la diabetes, [RR 0,25 (IC 95% 0,15 – 0,42), NNT=17 (IC 95% 14 – 24)], el parto prematuro [ RR 0,70 (IC 95% 0,55 – 0,90), NNT=8 (IC 95% 5 – 23)] y la mortalidad perinatal [RR 0,35 (IC 95% 0,15 – 0,82) NNT=32 (IC 95% 19 – 109)]. Los mejores resultados están relacionados a programas de salud preconcepcionales tendientes a optimizar el control glicémico por medio del mejor acceso al automonitoreo, un buen tratamiento farmacológico, mantener valores normales de HBA1c, mantener un tamizaje para la pesquisa precoz de complicaciones y asesoramiento sobre las eventuales complicaciones materno fetales [2+].
¿Cuál es la prueba de laboratorio que permite evaluar el riesgo gestacional (teratogénesis y aborto) en la mujer con antecedente de DPG?
• Se recomienda que en la mujer diabética en edad fértil la concentración de glicemia preconcepcional debe mantenerse en rangos euglicémicos o lo más cercanos a estos valores. (C)
Una serie de estudios observacionales avalan la conclusión de que existe una estrecha relación entre glicemias maternas y malformaciones congénitas y abortos espontáneos. Es así que el riesgo de malformaciones congénitas aumenta a medida que aumentan los niveles de HbA1c(14). La evidencia actual sugiere que niveles de Hb1Ac ≤ 6,5% se relacionan a una incidencia de malformaciones congénitas similares a la de la población general [2+].
Buenas prácticas clínicas
En la mujer diabética en edad fértil la concentración de glicemia preconcepcional debe mantenerse en rangos euglicémicos o lo más cercano a estos valores. El objetivo del control metabólico preconcepcional es alcanzar un nivel de HbA1c ≤ 6,5%.
SEGUIMIENTO
¿Cómo se debe realizar el seguimiento metabólico de las pacientes con antecedente de DPG durante el embarazo?
• Se debe abogar por alcanzar niveles euglicémicos en gestantes diabéticas durante el embarazo.
• En la gestante portadora de DM1-2, el control glicémico durante su embarazo debe realizarse con glicemias postprandiales principalmente
en la DM1. El control preprandial también es fundamental para la dosificación de la insulina basal.
En la mujer diabética el alcanzar glicemias maternas normales en el período preconcepcional disminuye los riesgos de abortos espontáneos y
de malformaciones fetales. Durante el embarazo el alcanzar niveles euglicémicos reduce el riesgo de macrosomía, FMIU, hipoglicemia neonatal y membrana hialina en el RN (15) [4].
Existe evidencia que apoya el uso de mediciones de glicemias postprandiales por sobre las preprandiales durante el embarazo para alcanzar mejor los objetivos metabólicos propuestos y mejorar el resultado perinatal y materno [1+].
Existe evidencia controversial si el monitoreo continuo de glicemias es superior al convencional para optimizar el resultado perinatal [3].
¿Qué exámenes de control deben realizarse en el control de gestantes con antecedente de diabetes mellitus?
• Para las mujeres con DG que requieran tratamiento farmacológico (insulinoterapia), se sugiere algún tipo de prueba fetal prenatal. (C)
• El régimen de pruebas óptimo no se ha establecido a partir de estudios rigurosos. Se sugieren pruebas prenatales semanales, RBNS, test de movimientos fetales (TMF) si está indicado a partir de las 32 semanas de gestación y 2 veces por semana desde las 36 semanas. (C)
• Para las mujeres con DG bien controladas con terapia médica nutricional sola, se sugiere no realizar pruebas fetales prenatales. Estas pruebas de vigilancia antenatal deben ser indicadas siguiendo los protocolos de vigilancia para embarazos considerados de bajo riesgo. (C)
Buenas prácticas clínicas
No existe un consenso de que protocolo de seguimiento del bienestar fetal debe ser usado durante el embarazo en pacientes con DPG o DG. Lo que está medianamente claro es que deben ser mucho más rigurosamente seguidos aquellos embarazos complicados por diabetes que tengan un mal control metabólico. Las pruebas propuestas incluyen, TMF, RBNE y ecografía obstétrica Doppler con el objeto de evaluar hemodinamia fetal(16).
Ultrasonografía
• Estudio ecográfico de primer trimestre (11-14 semanas) para evaluar viabilidad embrionaria, ya que la tasa de abortos espontáneos es mayor en diabetes preexistente que en la población general, especialmente aquellas que tienen un mal control metabólico previo al embarazo(17) [2 ++].
• Estudio ecográfico de segundo trimestre (20 –25 semanas) para evaluar morfología fetal, especialmente corazón, y flujometría Doppler de arterias uterinas en aquellas pacientes con antecedente de DPG y/o vasculopatía (nefropatía y/o retinopatía). Incluyendo Doppler de arteria umbilical y sobre todo, ecocardiografía fetal estructural avanzada(18,19).
• Estudio de tercer trimestre (30 - 34 semanas) para evaluar curva de crecimiento fetal y volumen de líquido amniótico (ILA) con el fin de seleccionar a pacientes en riesgo con mal control metabólico(20).
Se debe indicar flujometría Doppler de territorio materno-fetal, especialmente evaluación de arteria umbilical (al menos hasta las 32 semanas) rutinariamente y sobre todo ante asociación de síndrome hipertensivo del embarazo y restricción de crecimiento fetal. Se debe considerar ecocardiografía complementaria para la evaluación de hipertrofia ventrículo izquierdo y de septo de salida, alrededor de las 36 semanas de gestación(21).
Pruebas de bienestar fetal
• Prueba de movimientos fetales: la prueba de movimientos fetales se sugiere realizar durante el tercer trimestre (después de las 28 – 30 semanas). Dicha prueba consiste en contabilizar los movimientos fetales en reposo con paciente en decúbito lateral izquierdo durante 2 horas una vez al día independiente de la ingesta de comidas, considerándose reactivo con 10 ó más movimientos fetales(22). Frente a una disminución
de la percepción de movimientos fetales debe indicarse RBNE [4].
• Registro basal no estresante (RBNE): el registro basal no estresante debe indicarse bisemanalmente a partir de las 32 semanas de gestación y/o ante una prueba de movimientos fetales alterada (menos de 10 movimientos fetales)(23) [2++].
• Prueba de tolerancia a las contracciones (PTC): la PTC sólo está indicada previa inducción de trabajo de parto programado.
¿Qué exámenes de control deben realizarse en el control prenatal de gestantes con DG ?
Ultrasonografía
En aquellas pacientes con DG se deben indicar los mismos exámenes que la embarazada con antecedente de DPG, salvo la ecocardiografía fetal. La flujometría Doppler materno-fetal, con énfasis en la evaluación de arteria umbilical en casos especiales.
En embarazadas de tercer trimestre con mal control metabólico y/o fetos con estimación de peso fetal >p90 y polihidramnios, se deben evaluar antenatalmente signos ecográficos de hipertrofia ventricular y septal a través de ecocardiografía (34-38 semanas)(22).
Pruebas de bienestar fetal
En pacientes con buen control metabólico con curva de crecimiento fetal normal y sin polihidramnios, se indicará prueba de movimientos fetales a partir de las 32 semanas de gestación(24). En pacientes con buen control metabólico con curva de crecimiento fetal normal y sin polihidramnios, las pruebas de bienestar fetal (RBNE) se deben posponer hasta las 38 semanas, salvo que la prueba de movimientos fetales esté alterada. Desde las 38 semanas se indicará RBNE hasta el momento del parto.
MOMENTO DEL PARTO
¿A qué edad gestacional debe planificarse la interrupción del embarazo y por cuál vía en diabetes gestacional?
• En pacientes con buen control metabólico con curva de crecimiento fetal normal, sin polihidramnios y con pruebas de bienestar fetal normales, la interrupción del embarazo por medio de inducción de trabajo de parto estará indicada a las 41 semanas, salvo que estimación de peso fetal supere los 4.300 gramos. En dicho caso se programará operación cesárea electiva a partir de las 39 semanas. (B)
• Los beneficios potenciales incluyen menores tasas de macrosomía, GEG, tasas más bajas de distocia de hombros y menores tasas de parto por cesárea. (B) En estimación de peso fetal sobre 4.500 gramos, la operación cesárea disminuye el riesgo de distocia de hombros y sus consecuencias(25) [3].
En estimación de peso fetal sobre 4.500 gramos, se necesitan 443 operaciones cesáreas para prevenir una injuria del plexo braquial. En estimación de peso fetal sobre los 4.000 gramos se necesitan 489 operaciones cesáreas para prevenir una injuria del plexo braquial(26) [3].
Buenas prácticas clínicas
A pesar de carecer de evidencia concluyente, parece razonable que aquellas pacientes con mal control metabólico, insulinorrequirentes y con otros factores de riesgo asociado, se manejen de la misma manera propuesta que para pacientes con antecedente de DPG.
En pacientes con buen control metabólico con curva de crecimiento fetal normal, sin polihidramnios y con pruebas de bienestar fetal normales, la interrupción del embarazo por medio de inducción de trabajo de parto estará indicada a las 41 semanas, salvo que la estimación de peso fetal supere los 4.300 gramos. En dicho caso se programará operación cesárea electiva a partir de las 39 semanas [3].
¿A qué edad gestacional debe planificarse la interrupción del embarazo y por cuál vía ante el antecedente de DPG ?
Buenas prácticas clínicas
La oportunidad de parto debe ser indicada basada en factores asociados al buen control metabólico, vasculopatía, afectación de órganos blancos y/o repercusión en la unidad feto placentaria (34-39 semanas).
La amniocentesis para certificar maduración pulmonar no está indicada en ningún caso.
En pacientes con buen control metabólico con curva de crecimiento fetal normal, sin polihidramnios y con pruebas de bienestar fetal normales, la interrupción del embarazo por inducción de trabajo de parto estará indicada a las 39 semanas, salvo que la estimación de peso fetal supere los 4.300 gramos. En dicho caso se programará operación cesárea electiva(27) [3].
REFERENCIAS
1. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001; 323:334-6.
2. World Health Organization 2006. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia. Report of a WHO/ IDF Consultation.
3. Guerin A, Nisenbaum R, Ray JG. Use of maternal GHb concentration to estimate the risk of congenital anomalies in the offspring of women with prepregnancy diabetes. Diabetes Care 2007;30:1920–5.
4. Macintosh MC, Fleming KM, Bailey JA, Doyle P, Modder J, Acolet D et al. Perinatal mortality and congenital anomalies in babies of woman with type 1 or type 2 diabetes in England, Wales, and Northern Ireland: population based study. BMJ 2006;333:177.
5. HAPO Study Cooperative Research Group, Metzger BE, Lowe LP, Dyer AR, Trimble ER, Chaovarindr U, Coustan DR et al. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008;358:1991–2002.
6. Langer O, Conway DL, Berkus MD, Xenakis EM, Gonzales O. A comparison of glyburide and insulin in women with gestational diabetes mellitus. N Engl J Med 2000;343:1134-8.
7. Rowan JA, Hague WM, Gao W, Battin MR, Moore MP. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med 2008;358:2003-15.
8. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications, report of a WHO consultation. Pt1: diagnosis and classification of diabetes mellitus. Geneva: WHO, 1999.
9. Position of the American Dietetic Association and American Society for Nutrition: Obesity, Reproduction, and Pregnancy Outcomes. J Am Diet Assoc 2009;109:918-27.
10. Metzger BE, Gabbe SG, Persson B, Buchanan TA, Catalano PA, Damm P et al. International Association of Diabetes and Pregnancy Study Groups Consensus Panel. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010;33:676-82.
11. Reyes Muñoz E, Parra A, Castillo Mora A, Ortega González C. Nuevos criterios diagnósticos de la Asociación Internacional de Grupos de Estudio de Diabetes y Embarazo: impacto sobre la prevalencia de diabetes mellitus gestacional en mujeres mexicanas. 62 Congreso Mexicano de Ginecología y Obstetricia, volumen 79, Suplemento 1, 2011.
12. Benhalima K, Hanssens M, Devlieger R, Verhaeghe J, Mathieu C. Analysis of pregnancy outcomes using the new IADPSG recommendation
compared with the Carpenter and Coustan criteria in an area with a low prevalence of gestational diabetes. Int J Endocrinol 2013;2013:248121.
13. Fescina RH, De Mucio B, Díaz Rossello JL, Martínez G, Serruya S, Durán P. Continuo de atención de la mujer y el recién nacido. Centro Latinoamericano de Perinatología - Salud de la Mujer y Reproductiva. 3ra edición Montevideo, CLAP/SMR 2011.
14. Consensus Committee. Consensus statement on the worldwide standardization of the hemoglobin A1C measurement: the American Diabetes Association, European Association for the Study of Diabetes, International Federation of Clinical Chemistry and Laboratory Medicine, and the International Diabetes Federation. Diabetes Care 2007;30:2399-400.
15. National Collaborating Centre for Women’s and Children’s Health. Diabetes in pregnancy: management of diabetes and its complications from preconception to the postnatal period. Comissioned by the National Institute for Health and Clinical Excellence. March 2008.
16. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-86.
17. Ministerio de Salud de Chile. Guía Perinatal. 2003.
18. González R, Caertens M, Gómez R, Medina L, Gutiérrez J, Arriagada P et al. Anomalías congénitas en población general de bajo riesgo: screening con ultrasonido prenatal en un sistema público de salud. Rev Chil Obstet Ginecol 1999;64:247-55.
19. Parra M, Rodrigo R, Barja P, Bosco C, Fernández V, Muñoz H et al. Screening test for preeclampsia through assessment of uteroplacental blood flow and biochemical markers of oxidative stress and endothelial dysfunction. Am J Obstet Gynecol 2005;193:1486-91.
20. NICE clinical guidelines 63. Diabetes in pregnancy: management of diabetes and its complications from pre-conception to the postnatal period.
21. Kjos SL, Leung A, Henrt OA, Victor MR, Medearis AL. Antepartum surveillance in diabetic pregnancies: predictors of fetal distress in labor. Am J Obstet Gynecol 1995:173:1532-9.
22. Stümpflen I, Stümpflen A, Wimmer M, Bernaschek G. Effect of detailed fetal echocardiography as part of routine prenatal ultrasonographic screening on detection of congenital heart disease. Lancet 1996;348:854-7.
23. Ministerio de Salud. Guías perinatales 2014. Cuidados antenatales y anteparto.
24. The American College of Obstetricians and Gynecologists. Gestational diabetes mellitus. Practice Bulletin No137. Obstet Gynecol 2013;122:406-16.
25. Rouse DJ, Owen J, Goldenberg RL, Cliver SP. The effectiveness and costs of elective cesarean delivery for fetal macrosomia diagnosed by ultrasound. JAMA 1996;276:1480-6.
26. ACOG Committee on Practice Bulletins. ACOG Practice Bulletin. Clinical Management Guidelines for Obstetrician-Gynecologists. Number 60, March 2005. Pregestational diabetes mellitus. Obstet Gynecol 2005;105:675-85.
27. Spong CY, Mercer BM, D’ Alton M, Kilpatrick S, Blackwell S, Saade G, Timing of indicaded late-preterm and early-term Birth. Obstet Gynecol 2011;118 (2 Pt 1): 323-3.
Correspondencia:
 Dr. Enrique Valdés Rubio
Dr. Enrique Valdés Rubio
 Unidad Medicina Fetal, HCUCH
Unidad Medicina Fetal, HCUCH
 [email protected]
[email protected]
 562 2978 8881
562 2978 8881