Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Serie guías cínicas: Manejo de la enfermedad tiroídea en el embarazo y puerperio
Rev Hosp Clín Univ Chile 2019; 30: 153 - 72
Paula Vergara U., Verónica Araya Q., Alvaro Sepúlveda-Martínez, Mauro Parra-Cordero
El embarazo tiene un importante impacto sobre la glándula tiroídea. En regiones con buen aporte de yodo, su volumen puede aumentar hasta un 10% y en regiones con bajo aporte, puede alcanzar hasta un 20 – 40% de su volumen basal. La producción de hormonas tiroídeas T3 y T4 durante el embarazo puede aumentar hasta un 50%, asociado a un incremento en los requerimientos diarios de yodo de hasta 50%. La hormona HCG humana estimula directamente la producción de hormonas tiroídeas, generalmente produciendo una disminución de TSH, especialmente en el primer trimestre(1). Los cambios que ocurren en la TSH son en espejo con respecto a los de Beta hCG, es decir, mientras una sube la otra baja en forma muy similar. El máximo nivel de BhCG se evidencia entre las 8 y las 10 semanas de gestación y luego baja, llegando a niveles que se mantienen a partir de la segunda mitad del embarazo; lo mismo sucede en forma inversa con la TSH. En pacientes que presentan un alza muy importante de BhCG, el valor de TSH puede ser muy bajo, incluso suprimido(2). Además, existe un aumento del clearance renal de yodo, aparece la desyodasa placentaria y se produce mayor metabolización hepática de T4(3). La tiroides normo-funcionante es capaz de adaptarse a estos cambios fisiológicos a través de modificaciones en la producción de hormonas tiroídeas, cambios en la captación de yodo y la regulación del eje hipotálamo– hipófisis–tiroides.
La glándula tiroídea fetal inicia su desarrollo entre la semana 10 y 12 de la gestación; sin embargo, el inicio de la actividad productora de hormonas comienza a las 20 semanas. Es debido a esto que la función tiroidea en el feto durante el primer trimestre depende en su totalidad del paso transplacentario de T4 materna. La T4 materna atraviesa la placenta, la cual es rica en monodesiodasas II, donde es convertida en T3. La importancia de un adecuado y regulado paso transplacentario de estas hormonas radica en que de éstas depende el correcto desarrollo neurológico fetal. A partir de la semana 20 y hasta la semana 36 ocurre un incremento gradual en las concentraciones de TSH, TBG y T4 libre fetales, para así alcanzar los niveles del adulto. Al nacimiento ocurre un peak en la secreción de TRH y TSH que condiciona un incremento en los niveles de T4 y T3 neonatal; sin embargo, para el final de la primera semana de vida los valores de TSH y TRH regresan a la normalidad y posteriormente, alrededor de la sexta semana, los valores de T3 y T4 también disminuyen(4).
OBJETIVOS DE LA GUÍA CLÍNICA
1. Conocer los valores normales de TSH durante el embarazo y las últimas recomendaciones según sociedades internacionales.
2. Conocer el seguimiento y manejo de la enfermedad tiroídea durante el embarazo.
3. Conocer las modificaciones que se debe realizar al tratamiento de la enfermedad tiroídea previamente diagnosticada, al conocerse el estado de embarazo.
4. Conocer los fármacos recomendados para el manejo de la enfermedad tiroídea durante el embarazo y puerperio.
5. Conocer la utilidad de la pesquisa de anticuerpos antitiroídeos en el embarazo y a quién solicitarlos.
6. Conocer el seguimiento ecográfico adecuado del feto cuya madre está afectada por alguna patología tiroídea.
¿A QUIÉN VA DIRIGIDA LA PRESENTE GUÍA CLÍNICA?
La siguiente guía va dirigida a matronas, estudiantes de Medicina, becados/residentes de Ginecología y Obstetricia, becados/residentes de Medicina Materno-Fetal, obstetras que se desempeñan en hospitales de tercer nivel y especialistas en Medicina Materno-Fetal, con el fin de actualizar los conocimientos en el diagnóstico y manejo de la enfermedad tiroídea durante el embarazo y el puerperio.
NIVEL DE EVIDENCIA
1++: Metaanálisis de alta calidad, revisiones sistemáticas de estudios randomizados controlados (ERC) o ERC con riesgo muy bajo de sesgo.
1+: Metaanálisis bien diseñados, revisiones sistemáticas de ERC o ERC con riesgo bajo de sesgo.
1-: Metaanálisis, revisiones sistemáticas de ERC o ERC con alto riesgo de sesgo.
2++: Revisiones sistemáticas de estudios casocontrol o cohorte de alta calidad o estudios de caso-control o cohorte de alta calidad con riesgo muy bajo de factores confundentes o con alta probabilidad de que la relación sea causal.
2+: Caso-control o cohortes bien desarrollados con bajo riesgo de factores confundentes y una probabilidad moderada de que la relación sea causal.
2-: Estudios caso-control o cohorte con alto riesgo de factores confundentes y riesgo significativo de que la relación no sea causal.
3: Estudios no analíticos, por ejemplo, reporte de casos o serie de casos
4: Opinión de expertos
GRADO DE RECOMENDACIÓN
A: Al menos un metaanálisis, revisión sistemática o ERC en categoría 1++ y directamente aplicable a la población objetivo o
Una revisión sistemática de ERC o un nivel de evidencia consistente principalmente de estudios en categoría 1+ directamente aplicable a la población objetivo y demostrando consistencia global en los resultados.
B: Cantidad de evidencia que incluya estudios en categoría 2++ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 1++ o 1+.
C: Cantidad de evidencia que incluye estudios en categoría 2+ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 2++.
D: Evidencia nivel 3 o 4, o
Evidencia extrapolada de estudios 2+.
¿A qué embarazadas se debe realizar screening de enfermedad tiroídea?
• En Chile se recomienda el screening universal de enfermedad tiroídea a todas las mujeres embarazadas. Este debe ser realizado con medición de TSH y T4L en el primer trimestre del embarazo. (Grado de recomendación D)
• En mujeres en riesgo de desarrollar hipotiroidismo por tener antecedente de hemitiroidectomía/ tiroidectomía total, terapia con radioyodo o anticuerpos anti–TPO o anti–TG positivos, se debe realizar screening de hipotiroidismo cada 4 semanas desde el diagnóstico de embarazo hasta el segundo trimestre, y al menos 1 vez en el tercer trimestre. (Grado de recomendación D)
La patología tiroídea es frecuente en el embarazo con cifras de prevalencia que dependen de los valores hormonales normales utilizados como referencia y de las poblaciones estudiadas. La Encuesta Nacional de Salud (ENS) realizada en Chile los años 2009 y 2010 incluyó por primera vez en Chile preguntas de autorreporte de disfunción tiroídea. La prevalencia global de hipotiroidismo detectada fue de un 19,4% (21,5% en mujeres y 17,3% en hombres)(5). Un estudio del año 2012 que incluyó 510 embarazadas de 25.7 ± 6.6 años que inician control prenatal en el Hospital Clínico de la Pontificia Universidad Católica de Chile, utilizando los valores de normalidad sugeridos por la Endocrine Society, detectó una prevalencia de 0,6% de hipotiroidismo: 35,3% de hipotiroidismo subclínico (HSC) y 1% de hipertiroidismo clínico; frecuencias que resultaron muy superiores a las publicadas en otras poblaciones (HSC: 4% hasta un 8% en poblaciones con déficit de yodo). 5% de las pacientes con hipotiroidismo y 3,5% de las pacientes eutiroídeas tenían anticuerpos anti– TPO positivos(6). Los propios autores de este estudio concluyen que la razón más probable para la alta frecuencia de HSC sea el uso de puntos de corte inadecuados para nuestra población. Un aspecto importante de este trabajo es que estudió la presencia de autoinmunidad en estas pacientes. La frecuencia de antiTPO + es similar (10%) a la reportada internacionalmente, lo que hace suponer que la autoinmunidad no juega un rol fundamental en las diferencias encontradas(7). Dada la alta prevalencia reportada y su posible repercusión en el neurodesarrollo fetal, se recomienda screening universal a todas las pacientes embarazadas [3].
¿Cómo se define hipotiroidismo clínico en el embarazo?
• Se debe considerar que los valores de referencia de TSH dependen de cada población y origen étnico, y se ven influenciados por la ingesta y/o suplementación de la dieta con yodo, por lo que no hay un valor estándar único. (Grado de recomendación B)
• En Chile, independiente del trimestre de embarazo, debe considerarse como valor normal de TSH el rango de 0,4 – 4 UI/L. (Grado de recomendación B)
• Si en la primera evaluación de laboratorio se obtiene una TSH mayor que 4 UI/L, se debe realizar una segunda evaluación de TSH. Si persiste alterada, se debe derivar a Endocrinología para continuar estudio. (Grado de recomendación B)
• Si se obtienen 2 TSH mayor a 4UI/L, considerar inicio de tratamiento con Levotiroxina 50 ug/día (Grado de recomendación B)
• En pacientes con hipotiroidismo en tratamiento o antecedentes de tener anticuerpos Anti – TPO o Anti – TG positivos, antecedente de hemitiroidectomía, terapia con radioyodo o con diagnóstico reciente en el embarazo y que inician tratamiento, se debe considerar como valor normal de TSH el rango de 0,4 – 2,5 UI/L. (Grado de recomendación B)
Posterior a la concepción, la concentración de TBG circulante y T4 total aumentan desde la semana 7 de gestación y alcanzan un peak a las 16 semanas. Estas concentraciones se mantienen elevadas hasta el parto. En el primer trimestre, la HCG estimula directamente el receptor de TSH, aumentando la producción de hormonas tiroídeas y disminuyendo la concentración de TSH; por lo tanto, durante el embarazo, la mujer tiene valores menores de TSH que previo al embarazo. Un valor de TSH < 0.4 UI/L, considerado el valor menor normal en una mujer no embarazada, se puede encontrar en hasta un 15% de las mujeres embarazadas sanas. Este valor alcanza un 10% en el segundo trimestre y 5% en el tercer trimestre(1). Para efectos prácticos, es importante considerar que el hipertiroidismo subclínico (aquel que cursa con T4 libre normal) no se ha relacionado con efectos adversos durante el embarazo. En relación a la medición de T4, los cambios de su concentración sérica a lo largo del embarazo en relación a la mujer sana no embarazada, ya se han documentado. Los cambios son predecibles con un aumento de la concentración total de T4 desde la semana 7 a la 16, alcanzando un 50% por sobre el valor normal preembarazo. Posteriormente este nivel se mantiene durante el embarazo.
Actualmente muchos centros utilizan valores de referencia estándar de TSH para cada trimestre del embarazo (2,5 UI/L en el primer trimestre y 3,0 UI/L en el segundo y tercero). Esto se basa en las guías clínicas de las Asociación Americana de Tiroides (2011)(8), Sociedad de Endocrinología (2012)(4) y la Asociación Europea de tiroides (2014)(9). Estudios recientes han demostrado que estos valores de corte son muy bajos y que llevarían a sobrediagnóstico y sobretratamiento. Además, el tratamiento con levotiroxina en pacientes con TSH 2,5 - 4.0 UI/L no tendría ningún efecto benéfico, el cual sí se observaría con valores de TSH mayor que 4 UI/L, sobre todo en pacientes con anticuerpos positivos (principalmente disminución del riesgo de aborto primer trimestre)(10)[2++].
¿Se debe tratar el hipotiroidismo clínico en el embarazo?
• El hipotiroidismo ha demostrado consistentemente un aumento de riesgo de complicaciones en el embarazo, por lo que debe ser tratado. (Grado de recomendación A)
• El tratamiento farmacológico se debe realizar con levotiroxina (T4) con dosis variable dependiendo del valor de TSH:
TSH < 10 UI/L 25 – 50 ug/día
TSH 10 – 20 UI/L 50 – 100 ug/día
TSH mayor que 20 UI/L 1,0 – 1,6 ug/Kg/día
(Grado de recomendación D)
• El objetivo del tratamiento es lograr un valor de TSH < 2.5 UI/L. (Grado de recomendación D)
• No se recomienda el tratamiento con T3 (triyodotironina) por su vida media corta y riesgos de sobredosificación asociados a su uso. (Grado de recomendación C)
El hipotiroidismo materno ha demostrado consistentemente asociarse a un aumento del riesgo de complicaciones del embarazo, por lo que se recomienda realizar manejo farmacológico cuando se diagnostique. Se ha demostrado un aumento en el riesgo de parto prematuro, bajo peso al nacer, aborto espontáneo, hipertensión gestacional, muerte fetal y disminución del CI del recién nacido(11) [1+]. La presencia de T4 es esencial para el desarrollo del cerebro fetal. En tiroides humanas normofuncionantes, el ratio de producción de T4 en relación a T3 es 14:1. La gran mayoría de T3 presente en el sistema nervioso central fetal proviene de la conversión periférica de T4. El SNC fetal es relativamente impermeable a T3, por lo que se recomienda que la suplementación materna sea con levotiroxina oral(12) [2++].
¿Cómo se define hipotiroidismo subclínico en el embarazo?
• En mujeres embarazadas con TSH mayor que 4 UI/L o bocio palpable se debe buscar dirigidamente la presencia de anticuerpos antitiroídeos. (Grado de recomendación B)
• Se debe considerar hipotiroidismo subclínico en el embarazo, un valor de TSH mayor que 10 UI/L y T4L normal, independiente del estado de los anticuerpos. (Grado de recomendación B)
• Se debe considerar hipotiroidismo subclínico en el embarazo, cuando la TSH sea mayor que 4 UI/L con anticuerpos positivos y T4L normal. (Grado de recomendación B)
Varios estudios han demostrado una asociación positiva entre el estado de los anticuerpos antitiroídeos (antitiroglobulina, antiperoxidasa) con riesgo aumentado de aborto(13,14), hipotiroidismo materno(15), parto prematuro(16,17), tiroiditis postparto(18), morbilidad materna a largo plazo(19) y alteración del desarrollo neurológico infantil a largo plazo(20) [2+].
¿Se debe tratar el hipotiroidismo subclínico en el embarazo? (Considerar T4L normal)
• Se recomienda realizar tratamiento con Levotiroxina 50 ug/día, cuando haya presencia de anticuerpos Anti – TPO, y la TSH sea mayor que 4 UI/L. (Grado de recomendación B)
• Se recomienda realizar tratamiento con Levotiroxina 50 ug/día cuando la TSH mayor que 10 UI/L, independiente del título de anticuerpos. (Grado de recomendación B)
El año 2006 Negro et al demostró una reducción significativa del riesgo de aborto (-65%) y parto prematuro (-79%) en pacientes con anticuerpos anti TPO(+) y tratadas con levotiroxina en comparación con el grupo no tratado(21)[2+].
Otro estudio randomizado controlado demostró que mujeres eutiroídeas (TSH < 4 UI/L) con anticuerpos anti – TPO(+) tenían mayor tasa de aborto y parto prematuro, y que esto se reducía con el tratamiento con levotiroxina(21). 2 estudios han demostrado la reducción en la tasa de abortos en pacientes con anticuerpos anti – TPO(+), tanto en mujeres hipotiroídeas como eutiroídeas, por lo que es importante pesquisar la presencia de anticuerpos(17,22)[2+].
¿En mujeres que han sido diagnosticadas previamente con hipotiroidismo, y que se encuentran en tratamiento, es necesario realizar alguna modificación de la dosis durante el embarazo?
• En mujeres con hipotiroidismo en tratamiento y que se embarazan es necesario aumentar la dosificación de levotiroxina en 25 – 30% de la dosis diaria. (Recomendación de recomendación A)
• El cambio de la dosis debe ser lo más precoz posible al momento del diagnóstico de embarazo para evitar la aparición de hipotiroidismo clínico. (Grado de recomendación A)
• En mujeres no embarazadas con diagnóstico de hipotiroidismo en tratamiento que desea embarazo se recomienda un valor de TSH preconcepcional < 2.5 UI/L. (Grado de recomendación B).
Los requerimientos de T4 total no son estáticos durante el embarazo. El nivel de T4 total debe aumentar 40 – 50% durante el embarazo para mantener el estado eutiroídeo. En mujeres con diagnóstico de hipotiroidismo, la TSH y la HCG no pueden estimular la producción adecuada de T4. Si no se suplementa a la madre de forma adecuada, el incremento en la demanda va a sobrepasar la producción endógena y se va a producir un hipotiroidismo clínico(23)[1+]. Los estudios han demostrado que el aumento de requerimiento de T4 se produce tan precoz como a las 4 – 6 semanas de gestación. Estos requerimientos aumentan gradualmente hasta las 16 – 20 semanas de gestación y posteriormente alcanzan un plateau que se mantiene hasta el parto(24,25). Aproximadamente entre 50 a 85% de las pacientes con hipotiroidismo en tratamiento con levotiroxina requieren un incremento de la dosis durante el embarazo. La magnitud del incremento de la dosis depende principalmente de la causa basal del hipotiroidismo. El ajuste de dosis debe hacerse lo antes posible apenas realizado el diagnóstico de embarazo para evitar la aparición de hipotiroidismo clínico [2+].
Existen diferentes formas de realizar el ajuste en la dosificación(1):
1. Pacientes que reciben 1 tableta de levotiroxina al día independiente de la dosis debe aumentarse la ingesta desde 7 tabletas semanales a 9 tabletas semanales (esto corresponde a un incremento del 29% de la dosis de T4).
2. Pacientes que reciben 1 tableta de levotiroxina al día, incrementar en un 25 – 30% la dosis diaria (Ejemplo, cambiar levotiroxina 100 ug por levotiroxina 125 ug).
¿Cómo debe ajustarse la dosis de levotiroxina en el puerperio inmediato?
• En pacientes con hipotiroidismo diagnosticado previo al embarazo, posterior al parto se debe volver a la dosis de levotiroxina administrada pre – embarazo y se debe realizar un control de TSH y T4L a las 4 semanas posparto para eventual ajuste de dosis. (Grado de recomendación B)
• En pacientes que inician terapia con levotiroxina durante el embarazo se debe suspender la terapia al momento del parto y reevaluar la función tiroídea con TSH y T4L a las 4 semanas posparto. (Grado de recomendación C)
La necesidad de aumento de dosis de levotiroxina durante el embarazo es debido al efecto intrínseco de éste sobre la tiroides, por lo que al finalizar el embarazo se debe volver a la dosis preconcepcional y se debe realizar una evaluación de la función tiroídea a las 4 semanas postparto; sin embargo, un estudio(26) demostró que más de un 50% de las pacientes con diagnóstico de tiroiditis de Hashimoto, requieren un incremento en la dosis preconcepcional de levotiroxina después del parto presumiblemente debido a una exacerbación de la disfunción autoinmune tiroídea postparto por lo que es aún más importante recalcar la evaluación al mes postparto [2+].
¿Cómo se realiza el diagnóstico de hipertiroidismo en el embarazo?
• El diagnóstico de hipertiroidismo clínico se realiza con un valor de TSH bajo (< 0.4 UI/L) y un valor anormalmente alto de TT4, T4L o T3. (Grado de recomendación B)
• Un solo valor de TSH < 0.4 UI/L constituye criterio de derivación a Endocrinología para continuar estudio e iniciar tratamiento. (Grado de recomendación D)
• Es necesario realizar un examen físico exhaustivo de la glándula tiroides para poder orientar a la etiología (Bocio multinodular, nódulo funcionante, etc.) (Grado de recomendación B)
• Se recomienda evaluar la presencia de anticuerpos TRAb maternos para poder determinar la etiología del hipertiroidismo, de forma simultánea con la derivación a Endocrinología. (Grado de recomendación B)
Es normal observar una caída en el valor de TSH en el primer trimestre del embarazo, específicamente a partir de la semana 7, debido al efecto directo de HCG sobre la glándula tiroides. Una TSH suprimida (<0.1 UI/L) se puede observar en hasta un 5% de los embarazos normales(27,28). La causa más frecuente de hipertiroidismo en mujeres en edad fértil es la enfermedad de Basedow – Graves(29). Se encuentra en 0,4 – 1% de las mujeres y 0,2% de las embarazadas. Otras causas menos frecuentes no autoinmunes corresponden al bocio tóxico multinodular, el adenoma tóxico y la tiroiditis subaguda silente. Existe una condición específica del embarazo llamada tirotoxicosis gestacional transitoria, la cual está limitada a la primera mitad del embarazo. Se caracteriza por presentar valores elevados de T4L y TSH suprimida. Tiene una incidencia que depende de la localización geográfica y puede afectar al 2 – 3% de los embarazos. Se produce por la elevación de la HCG durante la primera mitad del embarazo, la cual estimula directamente la producción de hormonas tiroídeas. Generalmente se asocia a hiperémesis gravídica, pérdida de más que 5% del peso corporal, deshidratación y cetonuria. Esta condición es más frecuente de observar en embarazos gemelares, mola hidatidiforme y coriocarcinoma (condiciones con elevación importante de HCG)(29).
¿Cuál es el rol de la evaluación de los anticuerpos TRAb en el embarazo, en pacientes que han sido diagnosticadas con enfermedad de Graves?
• Si la paciente tiene historia previa de enfermedad de Graves, se recomienda derivación inmediata a Endocrinología al momento del diagnóstico de embarazo para continuar estudio y tratamiento. (Grado de recomendación D)
• Si la paciente tiene historia previa de enfermedad de Graves tratada con radioyodo o tiroidectomía se debe evaluar el nivel de anticuerpos TRAb junto con la función tiroídea en el primer trimestre del embarazo, aunque esté en tratamiento con levotiroxina e independiente del tiempo que haya pasado desde el tratamiento.(Grado de recomendación B)
• Si la paciente se encuentra en tratamiento con drogas antitiroídeas al momento del diagnóstico de embarazo, se recomienda una medición de TRAb en el primer trimestre. (Grado de recomendación C)
• Si el nivel de anticuerpos está elevado en el primer trimestre, debe realizarse una segunda evaluación a las 18 – 22 semanas de gestación. (Grado de recomendación B)
• Si el nivel de anticuerpos es bajo o indetectable en el primer trimestre, no se requiere una nueva evaluación a lo largo del embarazo. (Grado de recomendación C)
• Si la paciente requiere inicio de terapia antitiroídea posterior al primer trimestre, se recomienda realizar una evaluación de TRAb entre las 18 – 22 semanas de gestación. (Grado de recomendación B)
• Si se detecta elevación de TRAb a las 18 – 22 semanas o si la madre mantiene el tratamiento antitiroídeo en el tercer trimestre, se sugiere una evaluación de TRAb a las 30 – 34 semanas para determinar la eventual necesidad de seguimiento postnatal. (Grado de recomendación A)
Los anticuerpos TRAb son detectables en el 95% de los pacientes con enfermedad de Graves activa y los niveles pueden permanecer altos después de la terapia con radioyodo o cirugía(30). Las indicaciones para solicitar la medición de TRAb en el embarazo incluyen historia de enfermedad de Graves no tratada o en tratamiento con drogas antitiroídeas, radioyodo o cirugía; antecedente de hijo previo nacido con hipertiroidismo o antecedente de tiroidectomía durante el embarazo previo(31) [1+]. En la gran mayoría de las pacientes, la concentración de TRAb disminuye a medida que avanza la gestación. La incidencia de hipertiroidismo o bocio fetal es de 1 al 5% de las pacientes con enfermedad de Graves activa o pasada y esto se asocia a morbimortalidad neonatal si es que no es reconocida y tratada a tiempo(29).
La detección de TRAb en el primer trimestre permite seleccionar a las pacientes en riesgo(32). Un valor mayor que 5 UI/L o 3 veces mayor al valor de referencia del laboratorio, en pacientes con antecedente de enfermedad de Graves tratada con cirugía o radioyodo, es indicación de seguimiento estricto en búsqueda de bocio fetal(31) [1+]. La evaluación de TRAb al final del embarazo en pacientes que aun requieren tratamiento antitiroídeo en el tercer trimestre, permite seleccionar a las pacientes que requerirán evaluación y seguimiento postnatal(31) [1+]. Posterior al parto, el clearance fetal de las drogas antitiroídeas es mucho más rápido que el clearance de TRAb, por lo que el feto puede volverse hipertiroídeo. Si los TRAb se vuelven indetectables, es aconsejable reducir la dosis o suspender las drogas antitiroídeas maternas para evitar el hipotiroidismo y bocio fetal.
¿Cuál es el tratamiento de la enfermedad de Graves durante el embarazo?
• El tratamiento del hipertiroidismo, y el uso y titulación de las drogas antitiroídeas son de exclusivo manejo del especialista en Endocrinología. (Grado de recomendación D)
• En pacientes muy sintomáticas a la espera de la derivación a Endocrinología, se recomienda el uso de propanolol 10 mg cada 6 – 8 horas por un periodo máximo de 4 – 6 semanas. (Grado de recomendación B)
• En pacientes con diagnóstico de enfermedad de Graves en tratamiento previo al embarazo que se encuentren eutiroídeas o utilizando dosis bajas de tratamiento (metimazol < 5 – 10 mg/día o propiltiouracilo < 100 – 200 mg/día), se recomienda descontinuar la terapia farmacológica frente al eventual riesgo teratogénico. Para esta decisión se debe considerar el tiempo de enfermedad, el tamaño del bocio, la duración de la terapia, la función tiroídea y el título de anticuerpos. Considerar que la decisión de suspensión de la terapia debe ser de manera conjunta con el Endocrinólogo tratante. (Grado de recomendación D)
• Al suspender la terapia farmacológica, se debe realizar control de función tiroídea cada 1 – 2 semanas en el primer trimestre. Si se mantiene eutiroídea, se puede realizar control cada 2 – 4 semanas en el segundo trimestre. (Grado de recomendación D)
• En una paciente con diagnóstico de enfermedad de Graves con alto riesgo de desarrollar tirotoxicosis si se suspende la terapia antitiroídea, se recomienda utilizar propiltiouracilo como primera línea de tratamiento, desde el diagnóstico de embarazo hasta las 16 semanas de gestación. (Grado de recomendación B)
• En las pacientes en tratamiento con metimazol que requieren mantener la terapia antitiroídea durante el embarazo, se recomienda realizar el cambio a propiltiouracilo al momento del diagnóstico de embarazo. (Grado de recomendación C)
• Al realizar el cambio de metimazol a propiltiouracilo, la dosis debe ser en razón de 1:20 (Ejemplo: metimazol 5 mg/día = propiltiouracilo 50 mg cada 12 horas). (Grado de recomendación B)
• Se debe utilizar la menor dosis posible de drogas antitiroídeas, con la que se alcance el control metabólico adecuado. (Grado de recomendación B)
• La tiroidectomía durante el embarazo solo se recomienda en escenarios especiales como alergia o contraindicaciones a todas las drogas antitiroídeas o incapacidad de alcanzar el estado eutiroídeo con altas dosis de drogas antitiroídeas.
• De ser necesaria, la tiroidectomía debe realizarse en el segundo trimestre. (Grado de recomendación A)
Varios estudios han demostrado que tanto las complicaciones médicas como obstétricas del hipertiroidismo se relacionan directamente con el control de la enfermedad y de la duración del estado eutiroídeo a través del embarazo(27,33). Un mal control de la tirotoxicosis se asocia directamente a mayor tasa de aborto espontáneo, hipertensión gestacional, prematurez, bajo peso al nacer, restricción de crecimiento fetal, muerte fetal, tormenta tiroídea e insuficiencia cardíaca materna(34,35) [2+]. Hay estudios que demuestran que la exposición fetal a un exceso de hormona tiroídea materna, podría determinar una programación genética que predispone a los recién nacidos a presentar trastornos del neurodesarrollo y convulsiones(36).
El tratamiento de primera línea durante el embarazo lo constituyen las tionamidas, dentro de las que se encuentran el metimazol, carbimazol y propiltiouracilo [1-]. Las tres inhiben la síntesis de hormonas tiroídeas mediante interferencia en la unión del yodo con la tirosina (inhibición de peroxidasa) e interferencia en la formación de tiroxina (T4) y triyodotironina (T3). El bloqueo no es absoluto, ya que la tiroides contiene reservorio de tiroxina unido a tiroglobulina, por lo que la restauración de la función tiroídea se produce en varias semanas. La dosis inicial depende de la magnitud de los síntomas, pero la dosis recomendada en el embarazo es metimazol (MMI) 5 –30mg/día, carbimazol (CM) 10–40mg/día y propiltiouracilo (PTU) 100–600mg/día. Se pueden observar efectos secundarios en 2 – 5% de las pacientes que utilizan tionamidas(37). El principal efecto adverso es el rash alérgico. Los efectos adversos graves, como agranulocitosis y falla hepática, ocurren en < 1% de los pacientes(38,39). Los efectos adversos generalmente ocurren dentro de los primeros 3 meses de iniciado o reiniciado el tratamiento. El PTU está enlistado por la FDA como la tercera droga más frecuente de producir insuficiencia hepática con necesidad de transplante hepático. Es por eso que su uso solo está limitado al primer trimestre del embarazo [2-], con excepción de las pacientes alérgicas al metimazol o con tormenta tiroídea. Hasta la fecha, no hay evidencia que demuestre que hacer un control rutinario de pruebas hepáticas durante la terapia con PTU reduzca la incidencia de falla hepática [1-]. El principal riesgo del tratamiento con drogas antitiroídeas es su potencial efecto teratogénico. En 1972 se describió la asociación entre el uso de metimazol y aplasia cutis(40). Otros defectos con asociación significativa al uso de metimazol/ carbimazol son dismorfias faciales, atresia cloacal y esofágica, defectos de pared abdominal, defectos de las vías urinarias y defectos del tabique ventricular(41,42)[1-].Estas anomalías del desarrollo pueden afectar al 2 – 4% de las pacientes expuestas al tratamiento durante el primer trimestre, especialmente entre las 6 – 10 semanas de gestación(41,42). También se han descrito anomalías congénitas asociadas al uso de PTU, principalmente malformaciones de vías urinarias que aparecen con la misma frecuencia que las asociadas al metimazol; sin embargo, son menos graves y producirían menos secuelas(43). Dado lo anterior se debe realizar una ecografía morfológica detallada entre las semanas 20 y 25 de gestación y complementar dirigidamente con ecocardiografía fetal(43)[1-].
Para manejo sintomático, es considerable el uso de propanolol 10 – 40 mg cada 6 – 8 horas para controlar los síntomas hipermetabólicos (taquicardia, sudoración), hasta alcanzar el estado eutiroídeo [2+]. En la gran mayoría de los casos se logra la suspensión del medicamento a las 2 – 6 semanas de iniciado el tratamiento con drogas antitiroídeas. El uso prolongado de betabloqueadores se ha asociado a restricción de crecimiento fetal, bradicardia e hipoglicemia neonatal(44) [1+]. Es posible lograr una descontinuación de la terapia antitiroídea en aproximadamente 20 – 40% de las pacientes en el tercer trimestre del embarazo. Es importante considerar siempre TSH en el valor normal bajo para evitar el sobretratamiento y el eventual bocio fetal.
¿Cómo debe realizarse el seguimiento ecográfico fetal de una embarazada con diagnóstico de enfermedad de Graves?
• Si los anticuerpos TRAb maternos están más de 2 veces sobre el valor normal (valor de referencia de laboratorio), es necesario monitorizar sistemáticamente al feto frente al riesgo de aparición de bocio/ hipetiroidismo fetal, incluso cuando la madre se encuentre eutiroídea. (Grado de recomendación A)
• En pacientes con TRAb más de 2 veces el valor normal se debe evaluar mensualmente mediante ecografía seriada el ancho y la circunferencia de la tiroides fetal a partir de las 20 semanas de gestación para la pesquisa de bocio fetal, que es el signo ecográfico de aparición más precoz. (Grado de recomendación C)
• El bocio fetal se diagnostica ecográficamente cuando la circunferencia tiroídea es mayor que p95 para el DBP o la edad gestacional (ver normograma – Tabla 1). (Grado de recomendación C)
• En fetos que presenten bocio, se debe evaluar mediante Doppler color la presencia de vascularización de la glándula. La vascularización central orienta a hipertiroidismo y la vascularización periférica orienta a hipotiroidismo. (Grado de recomendación C)
• En fetos que presenten bocio se debe considerar la evaluación de la madurez ósea y la frecuencia cardíaca fetal para determinar si corresponde a un bocio hipertiroideo o bocio hipotiroídeo. (Grado de recomendación C)
• No se recomienda la realización de cordocentesis de rutina para evaluar la función tiroídea fetal. Su utilidad se reserva a los casos de bocio fetal en los cuales los signos ecográficos no son claros en determinar si el feto está hipotiroídeo o hipertiroídeo. (Grado de recomendación D)
El hipertiroidismo neonatal autoinmune o enfermedad de Graves neonatal(45) es un trastorno raro generalmente transitorio que afecta al 2% de los hijos de madres con diagnóstico de enfermedad de Graves. Las principales complicaciones para el feto son bocio, insuficiencia cardíaca, hidrops, restricción del crecimiento, oligohidroamnios, prematurez, craneosinostosis, microcefalia y muerte fetal [1-]. Las manifestaciones neonatales incluyen taquicardia, hiperexcitabilidad, dificultad en la ganancia de peso, bocio, exoftalmia, fontanela anterior pequeña, edad ósea avanzada, hepatoesplenomegalia e insuficiencia cardíaca(45)[1+]. En recién nacidos severamente afectados puede observarse microcefalia, craneosinostosis y dificultades motoras, por lo que es necesario ir a buscar dirigidamente la presencia de anticuerpos maternos para lograr el diagnóstico precoz y tratamiento adecuado(45) [1+].
El hipertiroidismo autoinmune fetal y neonatal generalmente se produce por el traspaso transplacentario de anticuerpos maternos antireceptor de TSH (TRAb). La tirotoxicosis por enfermedad de Graves generalmente mejora en el segundo trimestre de la gestación por disminución de los anticuerpos TRAb, pero empeora en el periodo postparto. La mantención de la función tiroídea fetal normal, la cual es necesaria para el desarrollo cerebral óptimo, es compleja en las pacientes con enfermedad de Graves. El hipertiroidismo fetal se puede desarrollar cuando los receptores de TSH fetales se vuelven fisiológicamente respondedores al estímulo de TSH y TRAbs, generalmente alrededor de la semana 20 de gestación, principalmente en mujeres con altos títulos de TRAb(45). También puede ocurrir en hijos de madres que fueron tratadas hace años por enfermedad de Graves, pero que aún tienen anticuerpos circulantes, por ende, a toda mujer embarazada con diagnóstico de enfermedad de Graves activa o con antecedente de enfermedad de Graves tratada con radioyodo o tiroidectomía, independiente del tiempo transcurrido, se le debe solicitar la medición de anticuerpos TRAb al comienzo del embarazo(29). [1+]

Tabla 1. Normogramas de circunferencia tiroídea según edad gestacional y DBP(47)
Existen otras causas, mucho menos frecuentes de tirotoxicosis fetal que son de etiología no autoinmune, como son la mutación activante del receptor de TSH en el síndrome de Mc – Cune – Albright, las mutaciones de novo del receptor de TSH de herencia autosómica dominante o los adenomas funcionantes autónomos, que son excepcionalmente raros en fetos y niños, y mucho más frecuentes en adultos.
El hipertiroidismo materno puede afectar al feto a través de tres vías(46):
1. Por el incremento del riesgo de diferentes patologías gestacionales en pacientes no tratadas (preeclampsia, hipertensión gestacional).
2. Por paso transplacentario de los TRAb con capacidad de estimular el tiroides fetal y producir un bocio hipertiroideo fetal.
3. Por paso transplacentario de los fármacos antitiroídeos con capacidad de producir un bocio hipotiroideo fetal.
Para el diagnóstico precoz y tratamiento del hipertiroidismo o hipotiroidismo fetal es crucial la determinación de los anticuerpos TRAb. En pacientes con diagnóstico de enfermedad de Graves se recomienda la medición de anticuerpos al comienzo del embarazo y se debe realizar un seguimiento fetal ecográfico estricto si los valores exceden más de 2 veces el valor normal(46) [2+]. Se debe evaluar el ancho y circunferencia de la tiroides fetal a partir de las 20 semanas de gestación cada 4 semanas(46). El bocio fetal es el marcador ecográfico más precoz de disfunción tiroídea [2+]. Es necesario determinar si el bocio corresponde a hipertiroidismo o hipotiroidismo fetal. Para esta determinación existen otros marcadores ecográficos como la frecuencia cardíaca fetal, la vascularización de la glándula tiroides mediante el uso de Doppler color (ver Figura 1) y la evaluación de la madurez ósea fetal. La frecuencia cardíaca fetal mayor a 160 lpm, mantenido por un tiempo superior a 10 minutos, y sobre todo si se asocia a hidrops, orienta hacia un hipertiroidismo. De la misma forma, la vascularización central de la glándula tiroides evaluada con el Doppler color y la visualización del núcleo de osificación distal del fémur, previo a su edad gestacional normal de aparición que son las 32 semanas, traduce una madurez ósea acelerada sugerente de hipertiroidismo (ver Figura 2). Por el contrario, la vascularización periférica de la glándula tiroides y la ausencia de visualización del núcleo de osificación distal del fémur después de las 32 semanas de gestación, orientan a un hipotiroidismo(46) [2+]. La cordocentesis para estudio de la función tiroídea fetal no se recomienda realizar de rutina y su indicación debe estar reservada frente a casos dudosos, ausencia de respuesta a tratamiento farmacológico o cuando esté indicada la administración intraamniótica de levotiroxina(45,46)[2+].
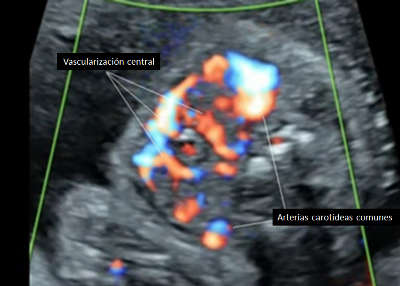
Vascularización central – Corte axial
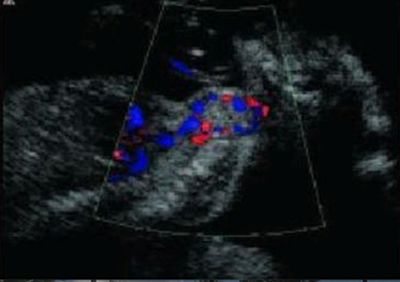
Vascularización periférica – Corte sagital
Figura 1. Vascularización de la glándula tiroides fetal

Figura 2. Núcleo de osificación secundario del fémur
La evaluación ecográfica de la tiroides fetal debe realizarse en un corte transverso, a nivel del cuello fetal, con amplificación máxima de modo que el cuello ocupe el 75% de la pantalla, y se deben visualizar ambas arterias carótidas y la traquea47. La tiroides fetal se encuentra entre ambas. Debe evaluarse la circunferencia tiroídea. Existen normogramas publicados en relación al DBP y a la edad gestacional (Figuras 3 y Tabla 1). El bocio fetal se establece como la circunferencia fetal mayor al percentil 95 para el DBP o para la edad gestacional determinada(47) [2+].

Corte axial - C: carótidas; T: tráquea; V: vértebra
Figura 3. Evaluación ecográfica de la tiroides fetal(47)
TRATAMIENTO DEL BOCIO FETAL(46)
Bocio hipertiroideo: si existe sospecha de bocio hipertiroídeo fetal en pacientes aun no tratadas, deberá iniciarse tratamiento con drogas antitiroídeas.
En caso de que la madre ya esté en tratamiento se incrementará la dosis. Si la madre desarrolla un hipotiroidismo como consecuencia del tratamiento, se administrará levotiroxina (única indicación de tratamiento combinado). Se debe observar una respuesta materna y fetal dentro de los primeros 14 días de tratamiento(48). La tiroidectomía materna solo se considerará en situaciones muy puntuales y se realizará de preferencia en el segundo trimestre.
Bocio hipotiroideo: la única alternativa de tratamiento es la administración de levotiroxina directamente en el compartimento fetal. Esta administración se realizará preferentemente vía intraamniótica, reservando la vía intravascular (cordocentesis) para aquellos casos de bocios que condicionen un problema en la deglución fetal (polihidramnios).
¿En mujeres no embarazadas que han sido diagnosticadas previamente con hipertiroidismo, y que desean embarazo, cuál debe ser el consejo preconcepcional adecuado?
• La paciente que se encuentra con un hipertiroidismo activo, en tratamiento, debe ser aconsejada de posponer el embarazo hasta que se encuentre eutiroídea. (Grado de recomendación B)
• Se debe considerar eutiroídea a la paciente con 2 pruebas de función tiroídea dentro del rango normal, separadas por 1 mes, sin cambio en la terapia farmacológica. (Grado de recomendación B)
• A las pacientes con enfermedad de Basedow Graves se les debe realizar consejería sobre los riesgos asociados a la enfermedad durante el embarazo, incluyendo la asociación de malformaciones congénitas con el uso de drogas antitiroídeas. (Grado de recomendación D)
• Se debe recomendar el uso de anticoncepción a pacientes con hipertiroidismo activo. (Grado de recomendación D)
Las drogas antitiroídeas como el propiltiouracilo o el metimazol son efectivas en alcanzar el estado eutiroídeo en 1 o 2 meses de tratamiento y generalmente disminuyen el título de anticuerpos, induciendo remisión de la autoinmunidad; sin embargo, su uso durante el embarazo se asocia a anomalías congénitas: 3 – 4% con el uso de metimazol y 2 – 3% con propiltiouracilo42,43,45 [2+]. El tratamiento con yodo radioactivo (I131) es fácil de realizar, bien tolerado por la paciente, de administración oral, fácilmente descontinuado y se asocia a una reducción en el tamaño del bocio; sin embargo, puede presentar una tasa de recaída de 50 – 70% posterior a la suspensión del tratamiento, y se ha descrito un incremento en los niveles de anticuerpos posterior al tratamiento, lo que podría empeorar la orbitopatía o el riesgo fetal(45).
El tratamiento definitivo es la tiroidectomía total(45) [2+]. Es muy infrecuente la reaparición del hipertiroidismo postcirugía. Es relativamente sencillo alcanzar un estado eutiroídeo con suplementación con levotiroxina; sin embargo, se han descrito complicaciones operatorias entre el 2 – 5% de las pacientes, se requiere suplementación con levotiroxina de por vida y se asocia a una cicatriz visible permanente, lo que puede ser una secuela importante.
¿Cómo se debe realizar el seguimiento del hipertiroidismo durante el embarazo?
• Durante el primer trimestre, se recomienda la evaluación de la función tiroídea con TSH y T4 libre. A partir de las 24 semanas de gestación, se recomienda la evaluación con TSH y T4 total. (Grado de recomendación D)
• Se debe realizar control con TSH y T4T/T4L cada 2 – 4 semanas desde el inicio del tratamiento. (Grado de recomendación B)
• Se debe realizar control con TSH y T4T/T4L cada 4 – 6 semanas una vez alcanzado el estado eutiroídeo. (Grado de recomendación B)
Se ha demostrado que tanto los anticuerpos antitiroídeos como las drogas antitiroídeas y las hormonas tiroídeas maternas cruzan efectivamente la placenta. Cuando la tiroides fetal se vuelve funcionante aproximadamente a las 20 semanas de gestación, ésta puede responder a la estimulación de los anticuerpos TRAb maternos y producir aumento de la producción de hormonas tiroídeas fetales y bocio fetal. La terapia antitiroídea materna también modula la función tiroídea fetal. Estas drogas tienden a ser más potentes en el feto que en la madre, por lo que cuando la madre está eutiroídea, el feto está sobretratado, por lo que para evitar un efecto deletéreo en el feto, el objetivo de la terapia es mantener los niveles de T4L/TT4 en el valor normal alto para la edad gestacional o justo por sobre éste(1) [2+].
¿Cómo se debe estudiar un nódulo tiroídeo diagnosticado por primera vez durante el embarazo?
• Toda paciente con el hallazgo de un nódulo tiroídeo diagnosticado por primera vez en el embarazo debe ser derivada de forma precoz a Endocrinología para continuar estudio y tratamiento. (Grado de recomendación D)
• Toda paciente con el hallazgo de un nódulo tiroídeo diagnosticado por primera vez en el embarazo debe ser sometida a una anamnesis y examen físico exhaustivos e indagar dirigidamente en antecedentes familiares de patología benigna y maligna de tiroides, y enfermedades como neoplasia endocrina múltiple 2 y poliposis adenomatosa familiar. (Grado de recomendación D)
• Se debe considerar de mayor riesgo a aquellas pacientes sobrevivientes de cánceres infantiles, en quienes se realizó radioterapia de cabeza, cuello o cráneo, o que fueron sometidas a radiación ionizante antes de los 18 años de edad. (Grado de recomendación B)
• A toda paciente con el hallazgo de un nódulo tiroídeo en el embarazo se le debe realizar estudio de pruebas tiroídeas. (Grado de recomendación B)
La prevalencia de nódulos tiroídeos diagnosticados durante el embarazo varía de un 3 – 21% en zonas con deficiencia leve a moderada de yodo (Alemania, China y Bruselas), aumentando con la paridad y alcanzando un 33% en pacientes multíparas de 3 o más partos. En un estudio belga(49), el 60% de los nódulos doblaron su tamaño, pero se mantuvieron entre 5 y 12 mm. En un estudio chino(50) también se reportó un incremento de volumen durante la gestación, pero con retorno a su tamaño normal en el postparto. Tanto el estudio belga como uno alemán(51) reportaron que 11 – 20% de las pacientes en quienes se diagnosticó un nódulo en el primer trimestre, desarrollaron un segundo nódulo tiroídeo durante la gestación. Al momento del diagnóstico de un nódulo tiroídeo en el embarazo es necesario realizar un ultrasonido para establecer las características del nódulo [2++]. Un patrón que incluya un nódulo sólido, hipoecogénico, de bordes irregulares y microcalcificaciones se asocia a más de 70% de riesgo de cáncer, mientras que un patrón quístico o espongiforme sin calcificaciones tiene un riesgo < 3%(52) [2++].
¿Cuál es el efecto de la terapia con radioyodo (I131) en futuros embarazos?
• En pacientes mujeres que desean embarazo se recomienda esperar al menos 6 meses desde finalizada la terapia con I131 para intentar concebir. (Grado de recomendación C)
• En pacientes hombres que desean embarazo se recomienda esperar al menos 4 meses desde finalizada la terapia con I131, para intentar concebir. (Grado de recomendación C)
Posterior al tratamiento quirúrgico del cáncer tiroídeo, muchas pacientes recibirán terapia con radioyodo (I131) como terapia ablativa. 2 estudios(53,54) han evaluado los posibles efectos deletéreos del radioyodo en embarazos subsiguientes. Ningún estudio demostró incremento del riesgo de infertilidad, aborto espontáneo, muerte fetal, mortalidad neonatal, malformaciones congénitas, parto prematuro, bajo peso al nacer, mortalidad en el primer año de vida o cánceres en la descendencia [2++]. El tratamiento con radioyodo puede producir un funcionamiento hormonal subóptimo de la tiroides durante el primer mes post tratamiento, por lo que se recomienda esperar al menos 6 meses para asegurar un buen control de la función hormonal antes de intentar un embarazo [2++]. En el caso de los hombres sometidos a terapia con I131, ésta puede afectar la espermatogénesis. Un estudio observó un incremento de la FSH, dosis–dependiente y una disminución de la motilidad espermática normal, por lo que se recomienda esperar al menos 120 días (ciclo de espermatogénesis), antes de intentar una gestación(55) [2++] (Figura 4).
REFERENCIAS
1. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27:315–89.
2. Hershman JM. Human chorionic gonadotropin and the thyroid: hyperemesis gravidarum and trophoblastic tumors. Thyroid 1999;9:653–7.
3. Mandel SJ, Spencer CA, Hollowell JG. Are detection and treatment of thyroid insufficiency in pregnancy feasible? Thyroid 2005;15:44–53.
4. De Groot L, Abalovich M, Alexander EK, Amino N, Barbour L, Cobin RH, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012;97:2543–65.
5. Wohllk N, pineda pedro, Mosso L. Guias Clinica AUGE en Manejo del Hipotiroidismo en personas de 15 años y mas. 2015.
6. Mosso M L, Martínez G A, Rojas MP, Margozzini P, Solari S, Lyng T, et al. Elevada frecuencia de enfermedad tiroidea funcional en embarazadas chilenas sin antecedentes de patología tiroidea utilizando el estándar de TSH internacional . Rev Méd Chile; 2012:1401–8.
7. González P, González Roca C, Walker B. Tratamiento del hipotiroidismo subclínico en el embarazo: análisis de la evidencia desde el punto de vista de la medicina obstétrica. Contacto Científico; Vol 7 Núm 4 Contacto Científico [Internet] 2017 Sep 15.
8. Stagnaro-Green A, Abalovich M, Alexander E, Azizi F, Mestman J, Negro R et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid [Internet] 2011; 21:1081–125.
9. Lazarus J, Brown RS, Daumerie C, Hubalewska- Dydejczyk A, Negro R, Vaidya B. 2014 European thyroid association guidelines for the management of subclinical hypothyroidism in pregnancy and in children. Eur Thyroid J 2014;3:76–94.
10. Korevaar TIM, Medici M, Visser TJ, Peeters RP. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nat Rev Endocrinol [Internet] 2017 4;13:610.
11. Hou J, Yu P, Zhu H, Pan H, Li N, Yang H et al. The impact of maternal hypothyroidism during pregnancy on neonatal outcomes: a systematic review and meta-analysis. Gynecol Endocrinol 2016;32:9–13.
12. Henrichs J, Ghassabian A, Peeters RP, Tiemeier H. Maternal hypothyroxinemia and effects on cognitive functioning in childhood: how and why? Clin Endocrinol (Oxf) [Internet] 2013;79:152–62.
13. Stagnaro-Green A, Roman SH, Cobin RH, el-Harazy E, Alvarez-Marfany M, Davies TF. Detection of at-risk pregnancy by means of highly sensitive assays for thyroid autoantibodies. JAMA 1990;264:1422–5.
14. Prummel MF, Wiersinga WM. Thyroid autoimmunity and miscarriage. Eur J Endocrinol 2004;150:751–5.
15. Glinoer D, Riahi M, Grun JP, Kinthaert J. Risk of subclinical hypothyroidism in pregnant women with asymptomatic autoimmune thyroid disorders. J Clin Endocrinol Metab 1994;79:197–204.
16. Stagnaro-Green A. Maternal thyroid disease and preterm delivery. J Clin Endocrinol Metab 2009;94:21–5.
17. Negro R, Schwartz A, Gismondi R, Tinelli A, Mangieri T, Stagnaro-Green A. Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy. J Clin Endocrinol Metab 2010;95:E44-8.
18. Premawardhana LDKE, Parkes AB, John R, Harris B, Lazarus JH. Thyroid peroxidase antibodies in early pregnancy: utility for prediction of postpartum thyroid dysfunction and implications for screening. Thyroid 2004;14:610–5.
19. Mannisto T, Vaarasmaki M, Pouta A, Hartikainen A-L, Ruokonen A, Surcel H-M, et al. Thyroid dysfunction and autoantibodies during pregnancy as predictive factors of pregnancy complications and maternal morbidity in later life. J Clin Endocrinol Metab 2010;95:1084–94. 20. Li Y, Shan Z, Teng W, Yu X, Li Y, Fan C, et al. Abnormalities of maternal thyroid function during pregnancy affect neuropsychological development of their children at 25-30 months. Clin Endocrinol (Oxf) 2010;72:825–9.
21. Negro R, Formoso G, Mangieri T, Pezzarossa A, Dazzi D, Hassan H. Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications. J Clin Endocrinol Metab 2006;91:2587–91.
22. Lepoutre T, Debieve F, Gruson D, Daumerie C. Reduction of miscarriages through universal screening and treatment of thyroid autoimmune diseases. Gynecol Obstet Invest 2012;74:265–73.
23. Abalovich M, Gutierrez S, Alcaraz G, Maccallini G, Garcia A, Levalle O. Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 2002;12:63–8.
24. Alexander EK, Marqusee E, Lawrence J, Jarolim P, Fischer GA, Larsen PR. Timing and magnitude of increases in levothyroxine requirements during pregnancy in women with hypothyroidism. N Engl J Med 2004;351:241–9.
25. Yim CH. Update on the Management of Thyroid Disease during Pregnancy. Endocrinol Metab (Seoul, Korea) [Internet] 2016;31:386–91.
26. Galofre JC, Haber RS, Mitchell AA, Pessah R, Davies TF. Increased postpartum thyroxine replacement in Hashimoto’s thyroiditis. Thyroid 2010;20:901–8.
27. Glinoer D, Spencer CA. Serum TSH determinations in pregnancy: how, when and why? Nat Rev Endocrinol 2010;6:526–9.
28. Lambert-Messerlian G, McClain M, Haddow JE, Palomaki GE, Canick JA, Cleary- Goldman J, et al. First- and second-trimester thyroid hormone reference data in pregnant women: a FaSTER (First- and Second-Trimester Evaluation of Risk for aneuploidy) Research Consortium study. Am J Obstet Gyneco 2008;199:62.e1-6.
29. Andersen SL, Laurberg P. Managing hyperthyroidism in pregnancy: current perspectives. Int J Womens Health [Internet] 2016;8:497–504.
30. Laurberg P, Wallin G, Tallstedt L, Abraham- Nordling M, Lundell G, Torring O. TSH-receptor autoimmunity in Graves’ disease after therapy with anti-thyroid drugs, surgery, or radioiodine: a 5-year prospective randomized study. Eur J Endocrinol 2008;158:69–75.
31. Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M et al. Management of Graves’ disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab 2005;90:6093–8.
32. Cooper DS, Laurberg P. Hyperthyroidism in pregnancy. lancet Diabetes Endocrinol 2013;1:238–49.
33. Bouillon R, Naesens M, Van Assche FA, De Keyser L, De Moor P, Renaer M et al. Thyroid function in patients with hyperemesis gravidarum. Am J Obstet Gynecol 1982;143:922– 6.
34. Laurberg P, Bournaud C, Karmisholt J, Orgiazzi J. Management of Graves’ hyperthyroidism in pregnancy: Focus on both maternal and foetal thyroid function, and caution against surgical thyroidectomy in pregnancy. Eur J Endocrinol 2009;160:1–8.
35. Davis LE, Lucas MJ, Hankins GD, Roark ML, Cunningham FG. Thyrotoxicosis complicating pregnancy. Am J Obstet Gynecol 1989;160:63–70.
36. Andersen SL, Olsen J, Laurberg P. Foetal programming by maternal thyroid disease. Clin Endocrinol (Oxf) 2015;83:751–8.
37. Mandel SJ, Cooper DS. The use of antithyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab 2001;86:2354–9.
38. Nakamura H, Miyauchi A, Miyawaki N, Imagawa J. Analysis of 754 cases of antithyroid drug-induced agranulocytosis over 30 years in Japan. J Clin Endocrinol Metab 2013;98:4776–83.
39. Watanabe N, Narimatsu H, Noh JY, Yamaguchi T, Kobayashi K, Kami M, et al. Antithyroid drug-induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50,385 patients with Graves’ disease. J Clin Endocrinol Metab 2012;97:E49-53.
40. Song R, Lin H, Chen Y, Zhang X, Feng W. Effects of methimazole and propylthiouracil exposure during pregnancy on the risk of neonatal congenital malformations: A meta-analysis. PLoS One [Internet] 20173;12:e0180108–e0180108.
41. Andersen SL, Laurberg P. Antithyroid drugs and congenital heart defects: ventricular septal defect is part of the methimazole/carbimazole embryopathy. Eur J Endocrinol 2014;171:C1- 3.
42. Andersen SL, Olsen J, Wu C Sen, Laurberg P. Birth defects after early pregnancy use of antithyroid drugs: a Danish nationwide study. J Clin Endocrinol Metab 2013;98:4373–81.
43. Li H, Zheng J, Luo J, Zeng R, Feng N, Zhu N, et al. Congenital Anomalies in Children Exposed to Antithyroid Drugs In-Utero: A Meta-Analysis of Cohort Studies. PLoS One [Internet] 2015;10:e0126610.
44. Rubin PC. Current concepts: beta-blockers in pregnancy. N Engl J Med 1981;305:1323–6.
45. Leger J. Management of Fetal and Neonatal Graves’ Disease. Horm Res Paediatr 2017;87:1–6.
46. Embarazo TY. PROTOCOLO: TIROIDES Y EMBARAZO TIROIDES Y EMBARAZO Hospital Clínic | Hospital Sant Joan de Déu | Universitat de Barcelona. 1. INTRODUCCIÓN. :1–16.
47. Gietka-Czernel M, Dębska M, Kretowicz P, Dębski R, Zgliczyński W. Fetal thyroid in two-dimensional ultrasonography: nomograms according to gestational age and biparietal diameter. Eur J Obstet Gynecol Reprod Biol [Internet] 2012;162:131–8.
48. Kurtoğlu S, Özdemir A. Fetal neonatal hyperthyroidism: diagnostic and therapeutic approachment. Turk Pediatr Ars [Internet] 2017;52:1–9. A
49. Glinoer D, Soto MF, Bourdoux P, Lejeune B, Delange F, Lemone M et al. Pregnancy in patients with mild thyroid abnormalities: maternal and neonatal repercussions. J Clin Endocrinol Metab 1991;73:421–7.
50. Kung AWC, Chau MT, Lao TT, Tam SCF, Low LCK. The effect of pregnancy on thyroid nodule formation. J Clin Endocrinol Metab 2002;87:1010–4.
51. Struve CW, Haupt S, Ohlen S. Influence of frequency of previous pregnancies on the prevalence of thyroid nodules in women without clinical evidence of thyroid disease. Thyroid 1993;3:7–9.
52. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016;26:1–133.
53. Sawka AM, Lakra DC, Lea J, Alshehri B, Tsang RW, Brierley JD, et al. A systematic review examining the effects of therapeutic radioactive iodine on ovarian function and future pregnancy in female thyroid cancer survivors. Clin Endocrinol (Oxf). 2008;69:479–90.
54. Garsi J-P, Schlumberger M, Rubino C, Ricard M, Labbe M, Ceccarelli C et al. Therapeutic administration of 131I for differentiated thyroid cancer: radiation dose to ovaries and outcome of pregnancies. J Nucl Med 2008;49:845–52.
55. Pacini F, Gasperi M, Fugazzola L, Ceccarelli C, Lippi F, Centoni R et al. Testicular function in patients with differentiated thyroid carcinoma treated with radioiodine. J Nucl Med 1994;35:1418–22.
Correspondencia:
 Dr. Mauro Parra-Cordero
Dr. Mauro Parra-Cordero
 Unidad de Medicina Materno Fetal, Departamento Obstetricia y Ginecología Hospital Clínico Universidad de Chile
Unidad de Medicina Materno Fetal, Departamento Obstetricia y Ginecología Hospital Clínico Universidad de Chile
 [email protected]
[email protected]
 562 2978 8880 / 562 2978 8881
562 2978 8880 / 562 2978 8881