Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Herpes zoster diseminado: caso clínico y revisión de la literatura
Herpes zoster classical clinical presentation is the acute onset of multiple vesicles over an erythematous base, disposed over one or two dermatomes with up to 20 vesicles located outside the main dermatome. Disseminated herpes zoster is an atypical and rare form of presentation of herpes zoster, which manifests with lesions beyond the described territory. It occurs mainly in patients with some type of cellular immunosuppression. The diagnosis is made with the medical history and physical examination, however, it should be confirmed with laboratory tests. Treatment must be initiated early to avoid serious complications, such as bacterial infection of the lesions, post-herpetic neuralgia, or even central nervous system involvement. The drug of choice is intravenous acyclovir that must be maintained until the cessation of the appearance of new lesions, and then switch to its oral presentation for another 5-7 days. Disseminated herpes zoster mortality rounds 5-15%. There are varicella-zoster virus vaccines, that have been shown to reduce the incidence of herpes zoster relapses, however its utility to disseminated herpes zoster is uncertain and further studies are required. We present the case of a male patient with a history of rheumatoid arthritis who consults with multiple vesicles distributed throughout his body.
Rev Hosp Clín Univ Chile 2020; 31: 216 - 22
Nicolás Moya G., Emilia Neves J.
El herpes zóster (HZ) es una trastorno neurocutáneo secundario a la reactivación endógena del virus varicela-zóster (VVZ), cuya presentación clínica típica se caracteriza por la aparición súbita de múltiples vesículas sobre base eritematosa que se pueden localizar en uno o dos dermatomas contiguos o no, pudiendo además presentar hasta 20 lesiones fuera del dermatoma principal. Está asociado o no a malestar general, dolor, disestesia, alodinia y en algunos casos fiebre de forma variable(1). Por otro lado, el herpes zoster diseminado (HZD) es una presentación clínica atípica e infrecuente del HZ que se caracteriza por presentar múltiples lesiones herpetiformes que no respetan la distribución dermatomérica clásica y/o presentan más de 20 lesiones fuera del dermatoma principal, siendo más frecuente en pacientes inmunocomprometidos, quienes pueden presentar serias complicaciones asociadas como neumonía, hepatitis, encefalitis o afectación de otros órganos(2,3).
Se presenta el siguiente caso clínico debido a la importancia en el diagnóstico precoz y oportuno del HZ, sobre todo en población inmunosuprimida con el fin de prevenir la diseminación del cuadro infeccioso.
CASO CLÍNICO
Paciente de 52 años, sexo masculino, con antecedentes de artritis reumatoide de larga data en tratamiento con leflunomida 20 mg/día, sulfazalazina 500 mg /día, metrotexato 25 mg semanal y acido fólico 5 mg/semanal. Posterior a trauma testicular refiere dolor urente en zona de glúteo, fosa renal e inguinal ipsilateral izquierda, por lo cual consulta a traumatólogo, quien diagnostica un cuadro de cuadro de lumbago agudo, indicando manejo con antiinflamatorios no esteroidales (AINES). Siete días luego de iniciado el tratamiento, refiere la aparición súbita de múltiples lesiones pápulovesiculares, algunas con aspecto hemorrágico, dolorosas, en zona glútea e inguinal derechas, además de múltiples lesiones vesiculares monomorfas asintomáticas que se extienden en todo el cuerpo, comprometiendo mucosas oral y genital, palmas y plantas. Es evaluado por dermatólogo mediante teledermatología, quien sospecha un HZD hemorrágico, siendo derivado al Servicio de Urgencia. Al ingreso, destaca hemodinámicamente estable y afebril. Niega el uso de algún medicamento nuevo. Al examen físico presenta lesiones vesículohemorrágicas confluentes que se distribuyen en los dermatomas L1 (inguinal anterior derecha) y S1- S2 (zona glútea ipsilateral) (Figura 1), además de lesiones monomorfas vesículo-costrosas de aproximadamente 2 mm de diámetro, distribuidas difusamente en todo el cuerpo, inclusive mucosa oral y genital, junto con algunas vesículas hemorrágicas en palmas y plantas de forma bilateral, Nikolsky negativo (Figura 2). Se solicitan exámenes generales y radiografía de tórax, destacando leve elevación de las transaminasas y VDRL negativo.
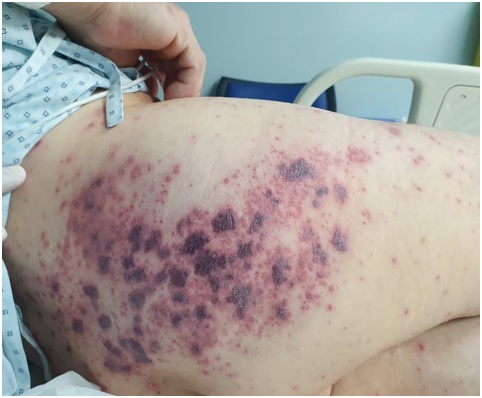
Figura 1. lesiones vesículo-hemorrágicas confluentes distribuidas en zona de dermatoma S1 y S2 derechas.
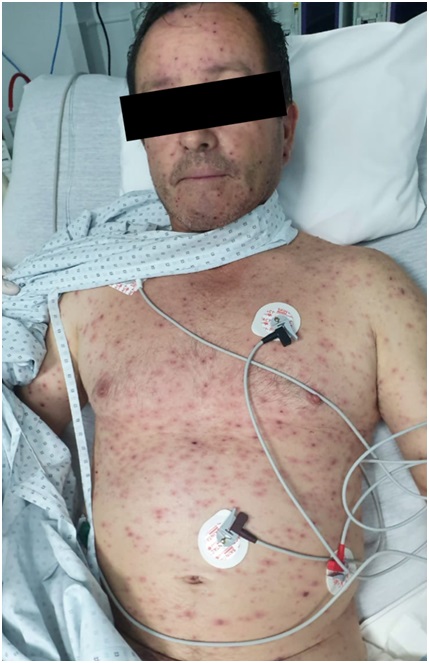
Figura 2. Múltiples lesiones vesículo-costrosas de distribución generalizada.
Debido a la sospecha clínica de HZD hemorrágico en el contexto de un paciente con inmunosupresión severa, es hospitalizado en Unidad de Tratamiento Intermedio con medidas de aislamiento respiratorio y de contacto, iniciándose tratamiento con aciclovir endovenoso (ev) 10 mg/kg cada 8 horas.
Durante su hospitalización es evaluado por equipo de Dermatología, quien solicita reacción de polimerasa en cadena (PCR) en sangre para virus Ebstein Barr que resulta negativo, además de PCR en sangre para VVZ, informándose como positivo, por tanto, confirmándose el diagnóstico de HZD hemorrágico. En conjunto, es evaluado por reumatólogo, quien indica suspensión del tratamiento inmunosupresor de la artritis reumatoide debido al extenso compromiso cutáneo del cuadro infeccioso y su reinicio posterior al alta. El paciente evoluciona de manera favorable, sin complicaciones, completando tratamiento con aciclovir ev por 10 días, resolviéndose el cuadro cutáneo y las alteraciones hepáticas, sólo manteniéndose con neuralgia en la zona de los dermatomas comprometidos, por lo que se trata con AINES. Fue dado de alta y se indicó control en Dermatología de manera ambulatoria.
DISCUSIÓN
El HZD protocolarmente se define cuando existe compromiso cutáneo mayor a 2 dermatomas contiguos o discontinuos y/o más de 20 vesículas en áreas distantes al dermatoma inicial(4,5).
Este cuadro se presenta en aproximadamente un 1 a 2% de los pacientes con HZ(6), siendo más frecuente en adultos sobre 60 años o en pacientes con algún tipo de inmunosupresión, principalmente con defectos de la inmunidad celular, como pacientes con virus de la inmunodeficiencia humana (VIH), neoplasias hematológicas o de forma iatrogénica secundaria al uso de fármacos como inmunosupresores, quimioterapéuticos, etc.(7). Se reporta que hasta un 40% de los pacientes con inmunosupresión que presentan un HZ podría evolucionar a su forma diseminada; por el contrario, el 65% de los pacientes al momento de presentar un HZD presentaría algún tipo de inmunocompromiso(8).
En cuanto a su fisiopatología luego de la infección primaria, el VVZ permanece latente en las neuronas sensitivas de ganglios de la raíz dorsal de la medula espinal, pudiendo reactivarse de manera espontánea o frente a ciertos estímulos hasta varias décadas después de la primoinfección(9). Al reactivarse, el virus viaja a través del nervio sensitivo afectado de forma retrograda, produciendo daño neuronal y con ello, dolor neuropático como pródromo, finalmente afectando el dermatoma correspondiente y manifestándose como aparición de un rash vesicular pruriginoso o doloroso sobre fondo eritematoso(10,11). Durante esta reactivación se produce una viremia transitoria que es controlada por la inmunidad adquirida durante la infección primaria, linfocitos T de memoria específicos para el virus, logrando contener la infección en uno o dos dermatomas y en menos de 20 vesículas aberrantes. Al contrario, en el HZD esta viremia persiste, debido a que la concentración de linfocitos T de memoria disminuiría, ya sea por senescencia del sistema inmune o secundaria a algún tipo de inmunosupresión celular como anteriormente se señaló, provocando la diseminación del virus(12).
Si bien las morfologías de las lesiones en paciente con HZD en su mayoría concuerdan con lo clásicamente descrito como múltiples vesículas con contenido seroso sobre base eritematosa que posteriormente se rompen dando paso a erosiones o costras serohemáticas, se han reportado presentaciones atípicas hasta en un 30% de los pacientes, en los cuales aparecen vesículas de contenido hemático, purulento, necróticas o necrohemorrágicas(5). Estas lesiones pueden ser acompañadas en su mayoría de dolor de tipo neuropático, ya sea urente o lancinante, y se describe con menos frecuencia el prurito y las parestesias como síntomas concomitantes. Del mismo modo, es posible observar compromiso de mucosas principalmente oculares cuando el dermatoma comprometido corresponde a la rama oftálmica del nervio trigémino, pero también oral, faríngea, genital según la extensión de las lesiones o el compromiso dermatomérico(8).
En relación a la extensión cutánea de las lesiones, en un estudio de cohorte retrospectivo de pacientes hospitalizados con el diagnóstico de HZD, el 95% de los pacientes debutó con lesiones en dermatomas definidos (presentación clásica) para posteriormente, en un rango variable entre 2 y 12 días, presentar diseminación de las lesiones (un 61% evolucionó a compromiso de 3 o más dermatomas y un 34% agregó lesiones generalizadas al dermatoma inicialmente comprometido). Tan sólo un 5% debutó con lesiones generalizadas en todo el cuerpo además del compromiso dermatomérico, siendo esta presentación la más infrecuente y de mayor gravedad, como la que presentaba nuestro paciente, ya que esto nos refleja un estado de inmunosupresión celular de mayor intensidad(5,8).
Los diagnósticos diferenciales de HZD son amplios, más cuando el antecedente de inmunosupresión no está claro. Algunos de ellos podrían ser la reacción adversa a medicamentos, sífilis secundaria o sífilis maligna en aquellos casos necróticos, primoinfección de VIH, además de otros cuadros, como HZ localizado con sobreinfección bacteriana, primoinfección por VVZ, rash urticarial, dermatitis de contacto, exantemas virales, entre otros. Por esto es muy importante una acabada y detallada historia clínica del paciente durante la consulta, ya que ésta nos puede entregar información clave que nos ayudará a descartar algunos diagnósticos diferenciales.
El diagnóstico de HZ localizado suele realizarse de forma clínica, pero en el HZD es cuando los métodos de laboratorio, enfocados en reconocer la infección por VVZ, adquieren mayor relevancia, sobre todo en pacientes con antecedentes de algún tipo de inmunosupresión, tanto por la mayor prevalencia de presentaciones atípicas, como por los múltiples diagnósticos diferenciales en este contexto(13). Entre las técnicas diagnósticas de laboratorio, las más utilizadas son: el cultivo viral, la inmunofluorescencia viral directa y la reacción en cadena de polimerasa (PCR). Esta última muestra un 91% de sensibilidad y cercana a 100% de especificidad, además de un menor tiempo para la obtención de resultados, por lo que es actualmente la técnica preferida y la más usada para el diagnóstico, pudiéndose obtenerse directamente de las lesiones cutáneas o mucosas (desde el fondo de la vesícula), de una muestra sanguínea e incluso, en el caso de sospecha de compromiso del sistema nervioso central por VVZ, del líquido cefalorraquídeo (LCR)(14,15).
Luego de la confirmación del diagnóstico es importante solicitar exámenes generales, ya que se describe la presencia de trombocitopenia en hasta un 56.1% de los pacientes en su mayoría leves (>100.000 plaquetas), leucopenia en 32% y alteración asintomática de las pruebas hepáticas en un 19.5%(5). Además, se recomienda solicitar otros exámenes dirigidos según indique la clínica, como radiografía de tórax (si presenta síntomas respiratorios), PCR para VVZ de líquido cefalorraquídeo (si presenta síntomas neurológicos), evaluación por oftalmólogo (si presenta alteración de la visión o dermatomas comprometidos cerca del ojo o punta nasal), entre otros.
Los objetivos del tratamiento del HZ son disminuir el dolor, reducir el riesgo de complicaciones y acelerar el proceso de curación. En el caso del HZD, el manejo debe llevarse a cabo con el paciente hospitalizado con indicación de aislamiento de tipo aéreo y de contacto. El tratamiento de elección en el caso de HZD es el aciclovir ev en dosis de 10 mg/kg cada 8 horas con ajuste según función renal a 10 mg/kg cada 24 horas con velocidad de filtración glomerular entre 10 y 50 mL/ min y 2.5 mg/kg cada 24 horas, si es menor a 10 mL/min(16-18). Se debe mantener vía ev como mínimo hasta el cese de aparición de nuevas lesiones con posterior cambio a vía oral por 5-7 días(19). Es importante tener en cuenta que una vez que el cuadro no está activo y las lesiones ya no están en vesículas, el paciente puede salir del aislamiento de contacto y aéreo.
Se han descrito casos de cepas de VVZ resistentes a aciclovir, principalmente en pacientes portadores de VIH. En este caso el tratamiento de elección es foscarnet, inhibidor de la DNA polimerasa viral cuya activación es independiente de tirosin-kinasa, de acuerdo a Breton et al(20). Frente a cepas resistentes tanto a aciclovir como a foscarnet, se ha descrito cierta eficacia de cidofovir; sin embargo, no ha sido del todo demostrada(21).
Otro punto importante y que muchas veces se pasa por alto, es consultar a los pacientes sobre sus contactos durante la etapa activa de la enfermedad, sobre todo en mujeres embarazadas sin antecedentes de varicela, debido a que durante esta etapa el paciente puede contagiar el virus.
Las complicaciones más frecuentes descritas en pacientes con HZD son la sobreinfección bacteriana de las lesiones cutáneas y la neuralgia postherpética, observándose en un 36.6% y 24.4% de los pacientes respectivamente(5). Destaca también la parálisis motora segmentaria en un 0.9 - 3.0% principalmente facial que en la mayoría de los casos sigue el compromiso vesicular dermatomérico(22).
Existen reportes de presentaciones del compromiso viral del sistema nervioso, entre ellos, meningitis herpética, ataxia cerebelar aguda, vasculopatía unifocal y encefalitis herpética, siendo esta última de significativa baja frecuencia, observándose en un 0.1-0.2% de pacientes con HZ y siendo levemente más prevalente en HZD con compromiso de dermatomas próximos al SNC(23,24). Además, publicaciones muestran datos obtenidos de autopsias de pacientes fallecidos por HZD con compromiso pulmonar con áreas focales de necrosis hemorrágica(8).
La mortalidad registrada para HZD fluctúa entre un 5 y un 15%. Distintos trabajos muestran ausencia de diferencia estadísticamente significativa en mortalidad entre pacientes inmunocompetentes e inmunosuprimidos; sin embargo, se ha reportado mortalidad de hasta 26% en pacientes portadores de VIH(5). Se ha determinado que el factor más importante en el pronóstico es la presencia de patología subyacente, principalmente neoplasias(8).
A modo de prevención de la reactivación de VVZ, existen vacunas vivas atenuadas que han demostrado efectividad en reducir la incidencia de HZ, aunque el periodo de protección inmunológica es corto y variable. Se necesitan más estudios para evaluar su efecto en HZD(25).
REFERENCIAS
1. Wollina U. Variations in herpes zoster manifestation. Indian J Med Res 2017;145:294–8.
2. Fujisato S, Urushibara T, Kasai H, Ishi D, Inafuku K, Fujinuma Y et al. A fatal case of atypical disseminated herpes zoster in a patient with meningoencephalitis and seizures associated with steroid immunosuppression. Am J Case Rep 2018;19:1162-7.
3. Cohen JI. Clinical practice: herpes zoster. N Engl J Med 2013;369:1766-7.
4. Lewis D, Schlichte M, Dao H. Atypical disseminated herpes zoster: management guidelines in immunocompromised patients. Cutis 2017;100:21-30.
5. Bollea-Garlatti ML, Bollea-Garlatti L, Vacas A, Torre A, Kowalczuk A, Galimberti R et al. Características clínicas y evolutivas de una población con herpes zoster diseminado: un estudio de cohorte retrospectiva. Acta Derm Sif 2017;108:145-52.
6. Thami G, Kaur S. Varicella, herpes zoster and dissemination. Pediatr Infect Dis J 2003;22:295-6.
7. Yoon K, Kim S, Lee E, Choi J. Disseminated herpes zoster in a immunocompetent elderly patien. Korean J Pain 2013;26:195.
8. Merselis J, Kaye D, Hook E. Disseminated herpes zoster. Arch Intern Med 1964;113:679- 86.
9. Kennedy P. Varicella-zoster virus latency in human ganglia. Rev Med Virol 2002;12:327– 34.
10. Gilden D, Kleinschmidt-DeMasters B, La- Guardia J, Mahalingham R, Cohrs RJ. Neurologic complications of the reactivation of varicella–zoster virus. N Engl J Med 2000;342:635-45.
11. Kennedy P, Gershon A. Clinical features of varicella-zoster infection. Viruses 2018;10:609.
12. Koshy E, Mengting L, Kumar H, Jianbo W. Epidemiology, treatment and prevention of herpes zoster: A comprehensive review. Indian J Dermatol Veneorol Leprol 2018;84:251-62.
13. Nagasako E, Johnson R, Griffin D, Dworkin R. Rash severity in herpes zoster: correlates and relationship to postherpetic neuralgia. J Am Acad Dermatol 2002;46:834-9.
14. Espy M, Teo R, Ross T, Svien K, Wold A, Uhi J et al. Diagnosis of Varicella-zoster Virus Infections in the Clinical Laboratory by LightCycler PCR. J Clin Microbiol 2000;38:3187-9.
15. Schmader K. Herpes zoster. Ann Intern Med 2018;169:17-32.
16. Shulman S. Acyclovir treatment of disseminated varicella inchildhood malignant neoplasms. Am J Dis Child 1985;139:137.
17. Nagafuchi S, Moriyama K, Takamatsu Y, Hayashi S, Niho Y, Takenaka A et al. Treatment of disseminated herpes zoster in six severely immunocompromised patients: acyclovir and vidarabine. Jpn J Med 1989;28:100–4.
18. Álvarez M, García V. Ajuste de fármacos en la insuficiencia renal. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día.
19. Burdett C, Mendoza N, Arora A, Bartlett B, Gewirtzman A, Tremaine A et al. A rare case of disseminated shingles in an immunocompetent patient following a 7-day treatment with oral valacyclovir. J Clin Virol
20. Breton G, Fillet A, Katlama C, Bricaire F, Caumes E. Acyclovir-resistant herpes zoster in human immunodeficiency virus-infected patients: results of foscarnet therapy. Clin Infect Dis 1998;27:1525–7.
21. Gnann Jr. JW. Antiviral therapy of varicella-zoster virus infections. En: Arvin A, Campadelli-Fiume G, Mocarski E et al, editors. Human herpesviruses: biology, therapy, and immunoprophylaxis. Cambridge: Cambridge University Press; 2007. Chapter 65. Disponible en: https://bit.ly/3pEynh1
22. Takama H, Tsukahara N, Hirayama M, Ito S, Sakuramoto C. Isolated doublé herpes zoster paresis involving the left facial nerve and the right peroneal nerve following disseminated herpes zoster. J Dermatol 2007;34:349–52.
23. Gilden D. Varicella zoster virus and central nervous system syndromes. Herpes 2004;11:S89A–S94A.
24. Ellis D, Barsell A, Riahi R, Stumpf B. Varicella zoster virus encephalitis in a patient with disseminated herpes zoster: report and review of the literature. Dermatol Online J 2014;21:13030.
25. Oxman M. Zoster vaccine: current status and future prospects. Clin Infect Dis 2010;51:197- 213.
Correspondencia:
 Emilia Neves Jiménez
Emilia Neves Jiménez
 Estudiante de Medicina Universidad de Chile
Estudiante de Medicina Universidad de Chile
 [email protected]
[email protected]
 56998426817
56998426817