Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Tumores de glándulas salivales: enfrentamiento diagnóstico inicial
It is described that salivary gland tumors account for up to 3-6% of head and neck tumors, 80% of these being located in the parotid gland. Broadly speaking, the smaller the gland, the greater the probability of malignancy. The most common clinical manifestation in tumor pathology is the appearance of a painless mass. Indicators of malignancy should be considered: chronic volume increase or rapid growth, facial paralysis, cranial nerve involvement, ulceration, and cervical lymphadenopathy. Ultrasonography should be the first imaging study, however, it provides limited information. MRI is the exam of choice for salivary gland tumors, whereas CT and PET-CT allow the study of local and remote invasion. FNA is controversial, it is not indicated for all patients, in parotid tumors a cytological examination is usually not necessary prior to surgery. Excisional biopsy is not recommended due to the risk of tumor seeding, neural damage, and salivary fistula. The goal of treatment in gland tumors is the removal of the glands, associated with lymph node dissection and adjuvant radiation therapy in indicated cases. The general practitioner must comprehensively address these pathologies to achieve a timely referral to the specialist.
Rev Hosp Clín Univ Chile 2021; 32: 60 - 8
Tomás González A., Lucas Fuenzalida M., Patricio Gac E., Francisco Rodríguez M., Patricio Cabané T., Daniel Rappoport W.
El sistema de glándulas salivales consta de tres pares de glándulas salivales mayores: las parótidas, submandibulares y sublinguales, además de las cientos de glándulas salivales menores que se distribuyen en la mucosa aerodigestiva superior. Todas las anteriores constituyen posibles ubicaciones de patología neoplásica(1). Si bien los tumores de glándulas salivales constituyen un pequeño porcentaje de los tumores de cabeza y cuello (3-6%), resulta crucial la temprana pesquisa de masas potencialmente malignas, con el fin de instaurar un tratamiento precoz. De igual forma es importante diagnosticar, estudiar y tratar aquellos tumores de curso benigno.
Las patologías de las glándulas salivales son variadas: desde infecciones, obstrucciones hasta tumores agresivos. En este artículo se expondrá sobre los lineamientos diagnósticos de la patología tumoral en las glándulas salivales.
ANATOMÍA
Es fundamental tener un pleno conocimiento de la anatomía de las glándulas salivales, cuya función radica en mantener la humedad y lubricación de la cavidad oral, además de participar en la digestión de almidones y mecanismos de defensa.
Las glándulas parótidas se encuentran en las fosas retromandibulares, por detrás de la rama ascendente de la mandíbula y ántero-inferior al conducto auditivo externo. Se trata de una estructura unilobulillar, por la cual atraviesa el nervio facial en su trayecto extracraneal. Este nervio divide la glándula en una porción superficial que contiene el 80% de la glándula y otra profunda con el 20% restante. Sus secreciones, principalmente serosas, desembocan a la cavidad oral a nivel del segundo molar superior por medio del conducto parotídeo(1,2) (Figura 1).
Figura 1. Anatomía de las glándulas salivales.
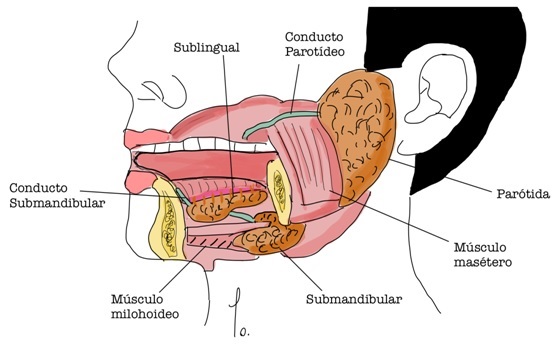
Las glándulas submandibulares se localizan en el espacio submandibular dentro del triángulo formado entre ambos vientres del músculo digástrico por inferior y medial, la rama mandibular por superior y en la profundidad los músculos milohioideos e hiogloso. Este triángulo también contiene la arteria y vena facial, nervios linguales e hipoglosos además del músculo milohioideo. La secreción es mixta, serosa y mucosa, la cual es drenada lateral al frenillo lingual por medio del conducto submandibular(1,2).
Las glándulas sublinguales se ubican debajo de la mucosa del piso de la boca y secretan contenido mucoso a través de los conductos de Rivinus que desembocan independientes o unidos al conducto de la glándula submandibular.
Por último, las glándulas salivales menores (entre 600-1.000) se distribuyen en los labios, mucosa oral, paladar, naso y orofaringe, las cuales secretan contenido mixto, mediante conductos propios directos a la mucosa oral(1,2) (Figura 1).
EPIDEMIOLOGÍA
Los tumores de las glándulas salivales son poco frecuentes. Se describe que corresponden a un 3-6% de los tumores de cabeza y cuello. Tienen una incidencia de 0,4 – 13,5 por cada 100.000 habitantes con una proporción similar entre hombres y mujeres. Se presentan habitualmente en la sexta década de la vida, siendo rara la presentación en niños(3).
A nivel local existen escasos reportes epidemiológicos de este tipo de tumores. En un estudio nacional (2017) con 286 pacientes, se reportan similares porcentajes de presentación y edad al diagnóstico; sin embargo, se reportó mayor proporción de mujeres que de hombres (1,86:1), resultado mucho mayor al compararlo con estudios internacionales(3).
UBICACIÓN E HISTOLOGÍA
A grandes rasgos y sustentado en la práctica clínica, se describe que el 80% de los tumores se asientan en la glándula parótida, seguido en orden decreciente por las glándulas submandibulares, las glándulas menores y las glándulas sublinguales(4,5). En el caso específico de las glándulas menores, el lugar más frecuente de presentación tumoral es el paladar, seguido de la mucosa yugal y lengua(4). Como regla general, mientras más pequeña la glándula, mayor probabilidad de que el tumor sea maligno. Se describe malignidad hasta un 15- 32% de los tumores de las glándulas parótidas; 41- 45%, en las submandibulares; 70-90%, de las sublinguales y entre un 50%, de las glándulas menores, según reportes internacionales(5).
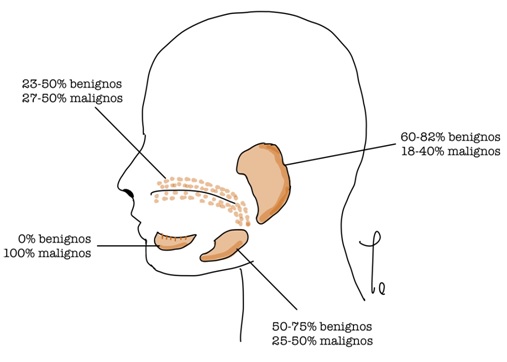
En la Figura 2 se expone una imagen que resume el porcentaje de malignidad según ubicación, de acuerdo a los últimos estudios estadísticos nacionales, siendo similar a lo reportado en estudios internacionales(3,6,7). La excepción a lo anterior son los tumores de las glándulas sublinguales, en que se reporta un 100% de malignidad a diferencia de los 70-90% en estudios internacionales.
Figura 2. Resumen de la malignidad según ubicación: estadística chilena (3,6,7)
Es importante tener en consideración que existe una gran diversidad histológica de la patología tumoral en las glándulas salivales. Recientemente la OMS actualizó la clasificación de tumores de cabeza y cuello(8) (Tabla 1).

El adenoma pleomorfo constituye el tumor benigno más frecuente, tanto en población pediátrica como adulta. Corresponde entre la mitad hasta dos tercios de la totalidad de tumores benignos de glándula salival, ubicándose principalmente en la parótida (hasta un 80%(9)). El tumor de Warthin es el segundo tipo más frecuente, representando el 6,5% de los tumores benignos(4).
Los carcinomas mucoepidermoides son el tipo histológico más frecuente de los tumores malignos y se ubican principalmente en la parótida, seguido de las submandibulares y sublinguales(10). El carcinoma adenoideo quístico es el segundo más frecuente, presentándose generalmente en las glándulas submandibulares(1,10).
FACTORES DE RIESGO
Los factores de riesgo para estas neoplasias son poco conocidos. Se describe que la radiación ionizante sería un factor causal, como también, la exposición al níquel y el consumo de cigarrillo, el cual se asocia especialmente con el tumor de Warthin. En un estudio estadounidense también se describe como factor de riesgo ser trabajador de peluquerías y salones de belleza(11). Es importante destacar que existe un aumento de la incidencia de estas neoplasias malignas en pacientes con inmunosupresión, particularmente en individuos portadores de VIH, los cuales tienen una mayor incidencia de carcinoma linfoepitelial, como también de enfermedades benignas de glándulas salivales, como es el síndrome sicca, infiltración difusa de linfocitos, sialoadenitis, entre otras(12). También se ha visto asociación con pacientes que presentan un tumor primario como linfoma de Hodgkin, meduloblastomas y relacionados con el virus Epstein Barr(5). En los adenomas pleomorfos se considera que mientras mayor tiempo de evolución, mayor posibilidad de transformación maligna, llegando a un 9,4% a los 15 años(13). La dieta podría ser un factor protector para desarrollar cáncer de glándulas salivales, como lo son el consumo de frutas y verduras con alto contenido de vitamina C(5).
DIAGNÓSTICO
Anamnesis
Cuando se evalúan las patologías de glándulas salivales es de suma importancia indagar dirigidamente sobre los factores de riesgo previamente descritos. Además, es importante preguntar sobre enfermedades actuales del ámbito reumatológico o antecedentes de tuberculosis.
La presentación clínica varía según la glándula afectada. La manifestación clásica y más común en la patología tumoral es la aparición de una masa(1). Como en todo abordaje inicial de una masa, es fundamental determinar el tiempo de evolución y los síntomas acompañantes. La patología benigna (sialoadenitis, sialolitiasis, ránula, infecciones bacterianas, entre otras) clásicamente se presenta con un curso agudo, acompañado de dolor e inflamación, y por el contrario, los tumores malignos de las glándulas salivales tienen un curso larvado sin inflamación, salvo en casos avanzados.
La mayor parte de los tumores parotídeos se generan en el lóbulo superficial y clínicamente se manifiestan como un aumento de volumen en la región periauricular. Cuando hay adormecimiento o debilidad facial ipsilateral al tumor, indica compromiso neural y por ende, mayor posibilidad de que sea maligno. En el caso particular de los tumores de glándulas submandibulares, habitualmente se presentan mediante un aumento de volumen indoloro en el triángulo submandibular correspondiente(14). Por otro lado, los tumores en las glándulas menores se presentan con un aumento de volumen en la mucosa de la cavidad oral, generalmente doloroso(6). La ulceración y sangrado de estos tumores debe hacer sospechar malignidad y, dependiendo de su ubicación, los pacientes pueden presentarse con obstrucción nasal, congestión, trismus e invasión de la base de cráneo con compromiso de pares craneales(5,14).
Si bien la mayoría de los tumores de las glándulas salivales se presentan como aumento de volumen asintomático, es importante evaluar si se acompaña de inflamación, en especial, si aumenta al comer: signo clásico de patología obstructiva, como la sialolitiasis(15). Un dolor intratable, con eritema, fiebre y síntomas sistémicos indica infección secundaria de la glándula. También recordar que el paciente se evalúa en su integridad y no sólo por el motivo de consulta inicial, por lo que será necesario indagar sobre síntomas sistémicos, como baja de peso no intencionada y sudoración nocturna, 64 Revista Hospital Clínico Universidad de Chile características clásicas de patología maligna. Por otro lado, y no menos importante, considerar la funcionalidad de las glándulas, preguntando por síntomas de ojo seco, boca seca y dolor de articulaciones, lo que pondría de manifiesto posibles enfermedades reumatológicas(15).
Examen físico
El examen físico de las glándulas salivales se concentra en la inspección y palpación del tumor. Es de gran importancia el correcto examen de cada glándula, incluyendo su respectivo conducto de drenaje y estructuras adyacentes, como puede ser el nervio facial en la parótida(5).
Una glándula sin hallazgos patológicos se describe como esponjosa y elástica, presentando descarga salival por el conducto respectivo al ser comprimida. La ausencia de flujo salival debe hacer pensar en obstrucción del conducto, generalmente debido a sialolitiasis, pero siendo obligatorio descartar patología maligna. En otro contexto, no se debe olvidar que la descarga purulenta hace sospechar una sialoadenitis bacteriana(16).
En pacientes con masas benignas, tiende a describirse un aumento de volumen nodular, con bordes bien delimitados, de carácter gomoso y firme. Por otro lado, existen una serie de hallazgos que se asocian con malignidad. La parálisis facial en el contexto de una masa parotídea es altamente sugerente de malignidad. Hocwald et al. describe una asociación significativa entre compromiso del séptimo par y presencia de malignidad (P=0,005)(7,17). Lo anterior no se describe en tumores benignos, incluso en aquellos de gran tamaño. La infiltración de la piel sobre la glándula (generalmente en parótida), al igual que el compromiso de la mucosa subyacente, generalmente asociado a ulceración de paladar, labios o mucosa yugal (común en glándulas menores), también se asocia a patología maligna(1,13).
Otro aspecto que debe ser evaluado dirigidamente es la presencia de adenopatías cervicales ipsilaterales, con características de malignidad como: tamaño mayor a 1,5 cms, adherencia a planos profundos, consistencia indurada-pétrea y la ubicación específica de éstas(18). Respecto a este último punto, se describe la ubicación del drenaje linfático inicial para cada glándula salival; sin embargo, siempre debe examinarse la región cervical en su totalidad:
• G. parótida: linfonodos intraparotideos, niveles I y II
• G. submandibular: linfonodos perivasculares adyacentes, niveles I y II
• G. sublingual: linfonodos submental y submandibulares (niveles Ia y Ib)
• G. menores en orofaringe: linfonodos retrofaríngeos(14)
En la glándula parótida, se debe palpar la mucosa oral a la altura del segundo molar superior en búsqueda del conducto parotídeo, mientras paralelamente se palpa la cara, siguiendo el conducto desde su origen (a la altura de la inserción del lóbulo de la oreja). Esto permite la identificación de sialolitasis, como importante diagnóstico diferencial(16).
En la glándula submandibular, la palpación bimanual a través del piso de la boca debe ser usada para diferenciar un origen glandular de uno linfático o cervical(1). También es posible evaluar el conducto submandibular al pedirle al paciente cerrar levemente la boca (esto relaja la musculatura del piso de la boca) y palpando el recorrido de éste desde posterior hacia anterior en búsqueda de litiasis, las cuales deberían salir por su orificio cercano al frenillo lingual(16).
En suma, los indicadores clínicos que sugieren malignidad de los tumores de glándulas salivales son: el aumento de volumen crónico o rápido crecimiento, parálisis facial, compromiso de pares craneanos, ulceración y adenopatías cervicales.
Imágenes
Es esencial tener claro el objetivo de todo examen que se le solicitará al paciente, considerando su sensibilidad, especificidad y costo. Con respecto a las imágenes y su valor en patología tumoral, el objetivo es delimitar con precisión la localización y extensión del tumor, además de evaluar metástasis linfonodal y a distancia.
La ecografía es el examen imagenológico que se utiliza en primera instancia. Es simple, rápido, de bajo costo y no irradia. Puede diferenciar entre un tumor quístico de sólido, como también, delimitar su tamaño si es superficial. Su sensibilidad es alta, llegando casi al 100% para detectar tumores, pero una limitada especificidad para diferenciar benignos de malignos(5,19). Sin embargo, la información que entrega es limitada en especial en tumores parotídeos profundos, además, de ser un método operador dependiente(1).
Considerando la realidad local, se recomienda realizar una ecografía como primera aproximación diagnóstica para tumores de parótida, submandibulares y sublinguales. De esta forma se podrá evidenciar la consistencia del tumor, su localización (extra o intraglandular) y posibles linfonodos comprometidos. No obstante, si existe la sospecha de malignidad con el examen clínico, se recomienda solicitar una tomografía computada (TC) o resonancia magnética (RM).
La TC con contraste es uno de los exámenes con mejor costo-beneficio, siendo especialmente útil para tumores inflamatorios. También sirve para evaluar el potencial de malignidad, donde un bajo flujo sanguíneo del tumor refleja, en general, malignidad por la alta cantidad de áreas necróticas en este tipo de tumores. Además se puede evaluar el compromiso locorregional y el compromiso óseo de la base de cráneo, mandíbula y hueso temporal(14).
Según la literatura actual, la RM es el examen de elección para los tumores de glándulas salivales, en especial para evaluar el compromiso neural(5). La RM, con sus imágenes potenciadas en T1 y T2, proporciona información específica de la glándula. Es útil para identificar el compromiso del lóbulo superficial o profundo de las parótidas, además de identificar el recorrido del nervio facial, siendo fundamental para pacientes con síntomas de infiltración neural. El uso de RM puede diferenciar tumores malignos de benignos con una sensibilidad del 80-87% y una especificidad del 76-100%, pudiendo ser mayor en RM con secuencias específicas; sin embargo, aún faltan reportes para su masificación(20). En general, la RM de tumores benignos muestra bordes bien definidos hiperintensos en T2 y habitualmente superficiales. Por el contrario, en tumores malignos hay invasión local, bordes mal definidos, necrosis central, nódulos periféricos e hipodensidad en T2. Es importante considerar que los tumores multifocales se pueden ver tanto en patología benigna (tumor de Warthin) como en maligna (linfoma y metástasis)(13).
La utilidad diagnóstica del PET-CT no está definida, ya que tanto tumores benignos como malignos captan el marcador de glucosa (18-fluorodeoxiglucosa). La utilidad de este examen radica especialmente en evidenciar metástasis a distancia.
Punción aspiración con aguja fina (PAAF)/biopsia
El rol de la PAAF es controversial. En algunos estudios reportan hasta un 40% de falsos negativos para tumores malignos(21). Es importante considerar que para procesar la muestra se necesita un patólogo experimentado. Además hay que tener presente las posibles complicaciones como hemorragia y lesiones nerviosas. Tiene una sensibilidad reportada que va del 73-82%, siendo mayor en lesiones benignas y una especificidad del 96-98%(22).
El diagnóstico histológico es recomendado para evitar cirugías mayores en tumores benignos o linfomas(5). La PAAF no está indicada para todos los pacientes. En la mayoría de los tumores parotídeos habitualmente no es necesario un examen citológico previo a la cirugía; sin embargo, en sospecha de tumores quísticos, tuberculosis, linfonodos y pacientes con enfermedades autoinmunes, el diagnóstico citológico es requerido, ya que cambia el tratamiento según corresponda(1,22). Además, tiene especial relevancia en distinguir patología inflamatoria de patología tumoral quística en niños, las cuales representan las causas más frecuentes, teniendo en consideración que el riesgo de malignidad en esta edad es mayor que en los adultos(5,23).
La biopsia excisional no está recomendada por el riesgo de siembra tumoral, daño neural y fístula salival. En tumores de glándulas parótidas la biopsia core guiada por ecografía puede ser considerada, en especial en PAAF no diagnósticas, tumores irresecables, sospecha de linfoma y enfermedad por IgG4. Si bien la sensibilidad y especificidad es mayor, 96% y 100% respectivamente, tiene más riesgo de hematoma y daño del nervio facial(24,25).
Tratamiento general
Después de haber hecho el diagnóstico clínicohistológico, el tratamiento de elección es la cirugía con extirpación total de la lesión.
A modo general y considerando que las parótidas son las glándulas más afectadas por la patología tumoral, es importante conocer a grandes rasgos los tipos de parotidectomía. La cirugía conservadora se basa en una resección del tumor con un margen de tejido sano. La parotidectomía superficial o suprafacial corresponde a la resección completa del lóbulo superficial, con la disección y preservación del nervio facial. Para tumores malignos de alto grado se recomienda la parotidectomía total en la que se reseca la glándula completa con preservación del nervio facial, a menos que haya compromiso franco de alguna de sus ramas(2). En el caso de que se haga una resección del nervio, se debe realizar un injerto nervioso para su reconstrucción o planificar algún tipo de reanimación facial(1). En el caso de las glándulas submandibulares y sublinguales, en general, el tratamiento radica en la resección completa de la glándula y tejidos adyacentes según corresponda. Según el tipo histológico, el compromiso local, regional y a distancia, se puede realizar la disección ganglionar correspondiente. También se puede utilizar la radioterapia adyuvante en tumores irresecables y en los estadios avanzados; se describe una reducción local de hasta el 54%(2).
CONCLUSIÓN
La patología de glándulas salivales es poco frecuente; sin embargo, es importante que todo médico general tenga una noción de las enfermedades que las afectan. En este sentido, existen diversas patologías que van desde infecciones virales banales, a bacterianas altamente infectocontagiosas y otras con tratamiento quirúrgico como los quistes de los conductos, sialolitiasis y ránula, cada una con sus manifestaciones características. Por otro lado, existe la patología tumoral de las glándulas salivales, la que cobra importancia al existir el riesgo de malignidad. El médico general tiene la función de abordar estas patologías de una forma integral para poder sospechar oportunamente las enfermedades que necesitan una pronta derivación al cirujano de cabeza y cuello. Con las directrices expuestas en este artículo, y teniendo en consideración que una exhaustiva anamnesis y examen físico logran el diagnóstico en un gran porcentaje de los pacientes, se busca ordenar y sintetizar los puntos generales del diagnóstico de la patología tumoral de las glándulas salivales, aportando además una idea general de los exámenes y tratamientos a los cuales posteriormente el paciente se verá enfrentado.
REFERENCIAS
1. Shah JP, Patel SG, Singh B, Shah JP. Jatin Shah’s head and neck surgery and oncology. Philadelphia: Elsevier/Mosby; 2012.
2. Navia Torelli AJ. Manual de cirugía de cabeza, cuello y mama. Navia Torelli, Alfonso Jorge Eds., 2013.
3. González AC, Skinner HR, Díaz AV, Ramírez AL, Espildora IG, González AS. Epithelial tumors of salivary glands. Review of 286 pathology reports. Rev Med Chile 2018;146:1159–66.
4. Spiro RH: Salivary neoplasms: Overview of a 35-year experience with 2,807 patients. Head Neck Surg 1986;8:177-84.
5. Guzzo M, Locati LD, Prott FJ, Gatta G, McGurk M, Licitra L. Major and minor salivary gland tumors. Crit Rev Oncol Hematol 2010;74:134–48.
6. Tapia C M, Hernández G T, Fredes C F, Urra B A, Compan J Á, Ortega R P. Tumores de glándula parótida: Experiencia quirúrgica Hospital Guillermo Grant Benavente. Rev Otorrinolaringol. Cir. Cabeza Cuello 2018;78:385–91.
7. Celedón C, Agurto M, Olavarría C, Paredes A, Niklischek E. Tumores de glándulas salivales. Experiencia de 20 años. Rev Otor Cir Cabeza y Cuello 2002;62:255–64.
8. El-Naggar AK, Chan JKC, Grandis JR, Takata T, Slootweg PJ. Tumours of salivary glands. In: Adv Ther WHO classification of head and neck tumours, 4th ed. Lyon: IARC;2017:159–202.
9. Seethala RR. Salivary gland tumors. Surgical Pathology Clinic 2017;10:155–76.
10. Son E, Panwar A, Mosher CH, Lydiatt D. Cancers of the major salivary gland. J Oncol Pract 2018;14:99–108.
11. Swanson GM, Burns PB. Cancers of the salivary gland: workplace risks among women and men. Ann Epidemiol 1997;7:369–74.
12. Sharma G, Nagpal A. Salivary gland disease in human immunodeficiency virus/acquired immunodeficiency syndrome: A review. World J Dermatol 2015;4:57-62.
13. Abdel Razek AAK, Mukherji SK. State-ofthe- art imaging of salivary gland tumors. Neuroimaging Clin N Am 2018;28:303–17.
14. Scott A. Salivary gland tumors: Epidemiology, diagnosis, evaluation, and staging. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc 2020. [Internet] 2020; [Consultado el 5 junio 2020]
15. Hoffman H. Salivary gland swelling: Evaluation and diagnostic approach. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc 2020. [Internet] 2020; [Consultado el 5 junio 2020]
16. Fazio S. Salivary gland stones. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc 2020. [Internet] 2020; [Consultado el 5 junio 2020]
17. Hocwald E, Korkmaz H, Yoo GH, Adsay V, Shibuya TY, Abrams J et al. Prognostic factors in major salivary gland cancer. The Laryngoscope 2001;111:1434–9.
18. González T, Fuenzalida L, Rappoport D, Gac P, Rodríguez F, Cabané P. Enfrentamiento a una masa cervical no tiroidea en atención primaria. Rev Hosp Clin Univ Chile 2020;32:223-30.
19. Gritzmann N, Rettenbacher T, Hollerweger A, Macheiner P, Hübner E. Sonography of the salivary glands. Eur Radiol 2003;13:964– 75.
20. Gökçe E. Multiparametric magnetic resonance imaging for the diagnosis and differential diagnosis of parotid gland tumors. J Magn Reson Imaging 2020;1–22.
21. Edizer DT, Server EA, Yiğit Ö, Yıldız M. Role of fine-needle aspiration biopsy in the management of salivary gland masses. Turk Arch Otorhinolaryngol 2016;54:105-11.
22. Liu CC, Jethwa AR, Khariwala SS, Johnson J, Shin JJ. Sensitivity, specificity, and posttest probability of parotid fine-needle aspiration: a systematic review and meta-analysis. Otolaryngol- Head Neck Surg 2016;154:9–23.
23. Ellies M, Laskawi R. Diseases of the salivary glands in infants and adolescents. Head Face Med 2010;6:1–7.
24. Thielker J, Grosheva M, Ihrler S, Wittig A, Guntinas-Lichius O. Contemporary management of benign and malignant parotid tumors. Front Surg 2018;5:1–17.
25. Sood S, McGurk M, Vaz F. Management of salivary gland tumours: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016;130:S142–9.
Correspondencia:
 Tomás González Arestizábal
Tomás González Arestizábal
 Estudiante de Medicina Universidad de Chile
Estudiante de Medicina Universidad de Chile
 [email protected]
[email protected]
 569 9579 0612
569 9579 0612