Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Aneurisma de la arteria comunicante posterior y parálisis del III nervio craneal. Caso clínico y revisión de la literatura
Rev Hosp Clín Univ Chile 2022; 33: 28 - 35
Luis Contreras S., Francisco Marín C., Daniel Galdames C., Hernán Delso P., Bayron Valenzuela C.
Los aneurismas cerebrales corresponden a una patología compleja debido al riesgo de ruptura anual y la consecuente hemorragia subaracnoidea (HSA). Estos se ubican generalmente en las bifurcaciones del sistema vascular cerebral, donde existe un mayor estrés de la pared arterial. Los aneurismas del segmento comunicante posterior de la arteria carótida interna (ACoP) representan un 25% del total de los aneurismas cerebrales(1).
Cuando se analizan los aneurismas ACoP, se considera tradicionalmente un conjunto de aneurismas localizados en la unión entre arteria carótida interna (ACI) y ACoP, ACoP propiamente tal, y lesiones en la unión entre ACoP y arteria cerebral posterior (ACP).
La parálisis unilateral del nervio oculomotor caracterizado principalmente por diplopía y ptosis es un signo precoz habitual y en algunos casos el único hallazgo neurológico en estos aneurismas de la ACoP no rotos. En algunas series incluso puede llegar hasta el 30%. Además, la parálisis del oculomotor también puede estar precedida por cefalea ictal, la que debe hacer sospechar una HSA. Sin embargo, la etiología de esta enfermedad es compleja, donde destacan otras etiologías tales como diabetes mellitus, trauma, tumores pituitarios, fístula del seno cavernoso, hemangioma cavernoso, trombosis del seno cavernoso, oftalmoplejía dolorosa, trauma, infarto, hemorragia subaracnoidea, e infecciones del sistema nervioso central(2,3).
El recorrido del nervio oculomotor es paralelo e inferior a la ACoP. Los aneurismas que se proyectan en sentido posterior e inferior pueden comprimir el nervio, causando una parálisis incompleta o completa (midriasis y desviación ocular lateral e inferior, vale decir, “hacia abajo y hacia afuera”) del nervio oculomotor(4).
Se presenta un caso clínico y breve revisión de la literatura de una paciente que debuta con parálisis completa del nervio oculomotor causada por un aneurisma no roto de la ACoP.
CASO CLÍNICO
Paciente de 38 años, sexo femenino y antecedentes de tabaquismo. Consulta en Servicio de Urgencia por tercera vez debido a un cuadro de cefalea de 15 días de evolución. Al interrogatorio dirigido refiere episodio de cefalea centinela de intensidad moderada, a la que se agrega en los días previos a la última consulta, dolor ocular izquierdo lancinante de alta intensidad, visión borrosa, fotofobia y diplopía vertical binocular. Al examen físico destacaba una agudeza visual conservada, fondo de ojo sin alteraciones, ptosis palpebral izquierda, anisocoria por midriasis arrefléctica a izquierda, mirada desviada hacia abajo y afuera.
Es hospitalizada para estudio metabólico e imagenológico. Se realiza escáner de cerebro y angio- TC cerebral, encontrándose un aneurisma sacular del segmento comunicante posterior de la ACI izquierda de disposición inferolateral descendente de 7 mm de profundidad, lobulado, con un cuello de 1,8 mm de diámetro estimado (Figura 1a, 1b, 1c y 1d). No se realiza angiografía cerebral dado que no se encontraba disponible en nuestro centro en ese momento. Se discute caso con equipo vascular, definiéndose la exclusión microquirúrgica del aneurisma, mediante clipaje como mejor alternativa para la paciente.

Figura 1a. TC sin contraste con mínima HSA en fisura silviana izquierda

Figura 1b. Angio-TC preoperatorio de ACoP izquierda, corte sagital

Figura 1c. Angio-TC preoperatorio de ACoP izquierda, corte coronal
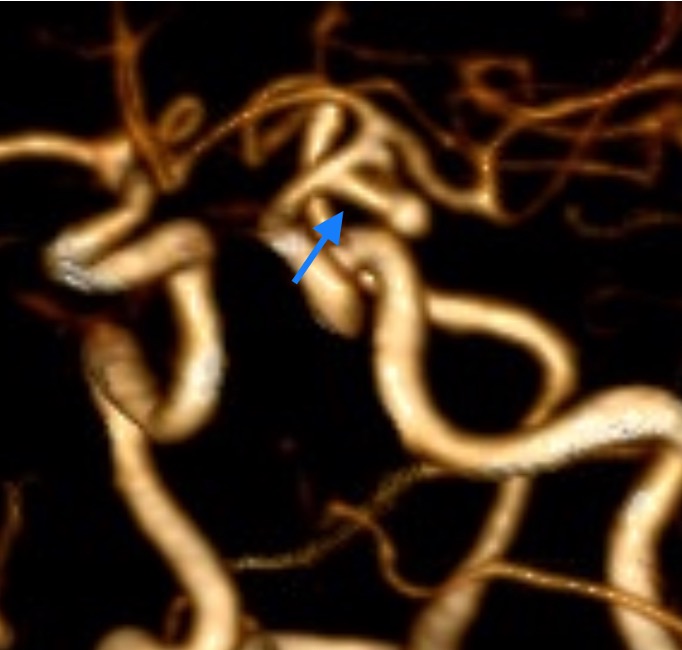
Figura 1d. Angio-TC preoperatorio reconstrucción 3D
Bajo neuromonitoreo intraoperatorio con potenciales evocados motores y somatosensitivos, se realiza acceso minipterional interfascial transilviano izquierdo. Se aprecia domo aneurismático orientado hacia lóbulo temporal. Se diseca axila distal y proximal del cuello aneurismático. Exclusión de aneurisma ACoP con clip recto (Figura 2a). Sin cambios en los potenciales evocados motores ni sensitivos. Se confirma patencia de ACoP, arteria coroidea anterior y sifón carotídeo, mediante videoangiografía intraoperatoria con verde de indocianina (Figuras 2b y 2c). Se confirma exclusión completa del aneurisma y se descomprime nervio oculomotor mediante aneurismotomía.
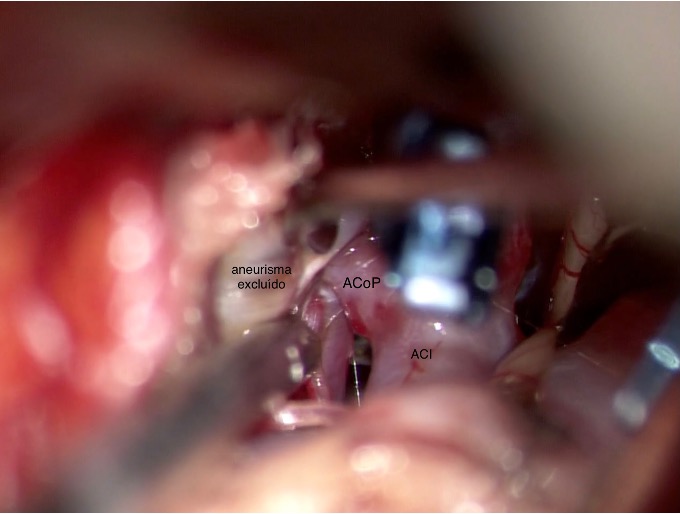
Figura 2a. Aneurisma clipado. Relación de clip con N. Oculomotor

Figura 2b. Aneurisma clipado. Recorrido libre de AcoP

Figura 2c. Videoangiografía con verde de indocianina. Permeabilidad vascular
La paciente tuvo un postoperatorio sin complicaciones. La angio-TC postoperatoria (Figura 3a, 3b y 3c) muestra exclusión completa de aneurisma. Al momento del alta logra movilidad ocular casi completa, mayor apertura palpebral y mayor reactividad pupilar izquierda, la cual se recupera completamente al control ambulatorio de las tres semanas post cirugía.
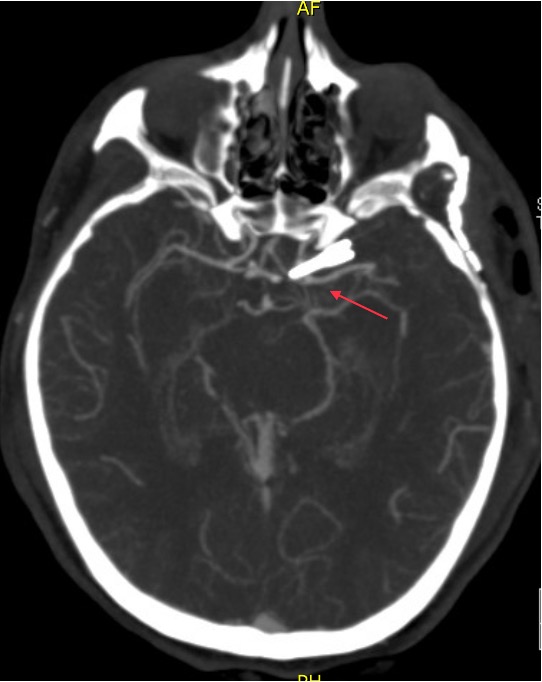
Figura 3a. Angio-TC postoperatorio, clipaje, corte axial
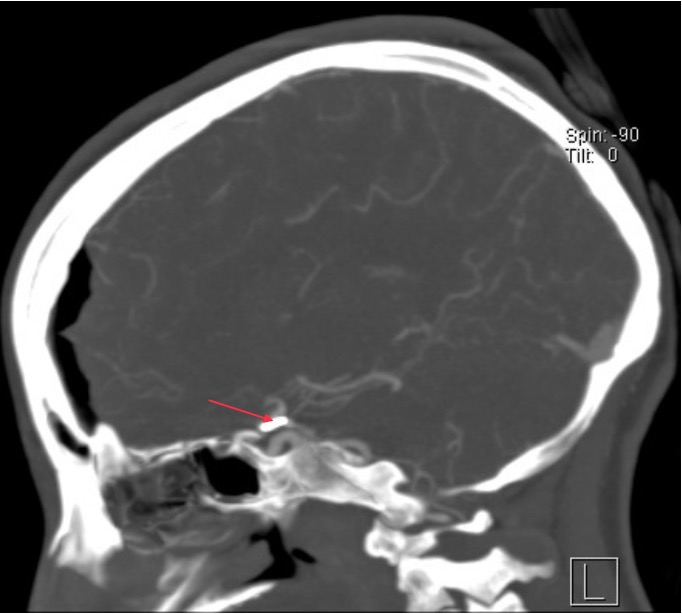
Figura 3b. Angio-TC postoperatorio, clipaje corte sagital

Figura 3c. Angio-TC postoperatorio, clipaje, reconstrucción 3D
DISCUSIÓN
La ACoP se origina de la pared posterior de la arteria carótida interna (porción C7, clasificación de Bouthillier).
El nervio oculomotor o III nervio craneal (III NC) tiene un recorrido paralelo a la ACoP. Debido a esto, los aneurismas con proyección posterior e inferior pueden impactar en el nervio, causando la parálisis del III NC (dilatación pupilar, mirada desviada hacia afuera y abajo). El nervio, con su origen aparente en la fosa interpeduncular mesencefálica, cursa de forma inicial entre el segmento P1 de la ACP por superior y la arteria cerebelosa superior (SUCA) por inferior, se adhiere a la membrana de Liliequist y sube al triángulo oculomotor, espacio limitado por los pliegues durales entre los procesos clinoídeos anterior y posterior (lado medial formado por el ligamento interclinoídeo), el borde del tentorio (límite lateral). El nervio entra por el ápice anterior del triángulo para salir al espacio subaracnoideo y viajar por el techo del seno cavernoso, justo por debajo la apófisis clinoides anterior ipsilateral(4).
El nervio oculomotor contiene fibras eferentes somáticas generales (ESG) y eferentes viscerales generales (EVG). Es un nervio motor puro que interviene en los movimientos oculares, la constricción de la pupila, la acomodación y la convergencia(2). Su compresión afecta la actividad del músculo elevador del párpado y cuatro músculos extraoculares: recto superior, recto medial, recto inferior y oblicuo inferior, músculos que permiten la movilización del globo ocular en los planos de la aducción, infraversión y supraversión. Adicionalmente, se afectan las fibras pupilomotoras parasimpáticas, anatómicamente de localización dorsal y periféricas, que permiten el movimiento del músculo liso de los cuerpos ciliares y esfínter del iris, causando una midriasis arrefléctica ipsilateral y parálisis de la acomodación (cicloplejía)(5).
La parálisis oculomotora del III NC en relación con un aneurisma de la ACoP debe considerarse una urgencia neurológica, ya que pudiera encontrarse en el contexto de una ruptura aneurismática o de un crecimiento aneurismático acelerado y, por lo tanto, un alto riesgo de ruptura. Entre los mecanismos causales fisiopatológicos de la parálisis, se describe el efecto de masa aneurismática, la pulsatilidad vascular y la irritación secundaria a ruptura, en contexto de una hemorragia subaracnoidea(6-8).
El gold standard para el diagnóstico de la patología aneurismática es la angiografía por sustracción digital con reconstrucción 3D; sin embargo, la angio-TC es un método menos invasivo que se ha convertido en una herramienta ampliamente aceptada debido a su disponibilidad y su alta sensibilidad y especificidad.
El caso presentado concuerda con lo descrito en la literatura donde los diagnósticos a descartar incluyen frecuentemente patologías tumorales, metabólicas o inflamatorias del seno cavernoso y/o órbitas; sin embargo, es importante destacar, en retrospectiva, que la paciente presentó un cuadro de cefalea con banderas rojas caracterizado por cefalea centinela que sugiere sospechar una patología vascular.
Se conoce como cefalea ictal cuando el paciente llega al Servicio de Urgencias con “el peor dolor de cabeza de su vida”. Se caracteriza por ser un dolor agudo que alcanza su máxima intensidad en menos de un minuto. Este síntoma nos debe hacer sospechar de causas secundarias, siendo la hemorragia subaracnoidea la primera causa a descartar (Tabla 1)(9). La cefalea centinela puede aparecer incluso días o semanas antes del episodio índice de sangrado, la cual es a menudo ignorada. Se estima que la incidencia de la cefalea centinela en HSA es entre 10-43%(10). Su fisiopatología es incierta, pero se postula que podría ser por microsangrados del aneurisma. La primera hemorragia puede ser fatal o resultar en una disfunción neurológica permanente.

Con respecto al manejo, el aneurisma de la ACoP es una patología grave que requiere la exclusión precoz del aneurisma (microquirúrgica o endovascular). Las indicaciones descritas en la literatura sobre clipaje de aneurisma ACoP incluyen parálisis del III par, aneurisma recurrente con coils previos, aneurismas múltiples, variantes anatómicas de la ACoP, asociación a hemorragia intracerebral y pacientes menores de 50 años(11).
Desde el desarrollo de los procedimientos endovasculares en los últimos años, ha existido un debate amplio en la literatura sobre cuál técnica (microquirúrgica o endovascular) tiene mejores resultados funcionales y de morbimortalidad a largo plazo en el manejo de la parálisis del III NC causada por aneurisma ACoP. Una reciente revisión sistemática y metaanálisis desarrollado por Zheng et al (2017) que analiza nueve estudios con un total de 247 pacientes, encontró que ambas técnicas poseen resultados similares en morbilidad a largo plazo, pero que el clip presenta superiores resultados en la recuperabilidad de la parálisis oculomotora por aneurisma roto y, resultados funcionales similares en caso de aneurisma no roto. Estos hallazgos son similares a otras publicaciones(12-15). Los mejores resultados posiblemente se deben a que el clipaje permite disminuir la hemorragia subaracnoidea, permite neurolisis microquirúrgica, disminuye la presión del saco aneurismático y elimina el efecto compresivo/ pulsátil del aneurisma sobre el III NC. La severidad inicial y la duración de la parálisis preoperatoria son factores importantes para la recuperación. Se recomienda el tratamiento temprano para lograr la recuperación, independiente de la presencia o ausencia de HSA(16).
En este caso clínico se prefirió el clipaje aneurismático debido a la clínica sintomática con parálisis completa del III par para lograr una adecuada exclusión del aneurisma y descompresión del nervio.
CONCLUSIÓN
Los aneurismas cerebrales son una patología grave con un amplio espectro de manifestaciones. Especial atención merece la parálisis súbita ipsilateral del nervio oculomotor con un amplio diagnóstico diferencial topográfico, donde una causa importante a considerar es el aneurisma de la arteria comunicante posterior que corresponde al 25% del total de aneurismas. El III NC tiene un recorrido anatómico particular que lo hace susceptible de su compresión por el sistema vascular. En el tratamiento, tanto la terapia microquirúrgica como endovascular, han mostrado similares y buenos resultados para el manejo de este tipo de aneurismas; sin embargo, la microcirugía ha mostrado mejores resultados funcionales del nervio oculomotor post tratamiento.
REFERENCIAS
1. Brisman J. Cerebral aneurysms. NEJM 2006;355:9.
2. Hafiz Khuram Raza, Hao Chen, Thitsavanh Chansysouphanthong & Guiyun Cui. The aetiologies of the unilateral oculomotor nerve palsy: a review of the literature. Somatosens Mot Res 2018;35:229-39.
3. Guresir E, Schuss P, Setzer M, Platz J, Seifert V, Vatter H. Posterior communicating artery aneurysm–related oculomotor nerve palsy: influence of surgical and endovascular treatment on recovery: single-center series and systematic review. Neurosurgery 2011;68:1527–30.
4. Lawton M. Posterior communicating artery aneurysms. The seven aneurysms. En: seven aneurysms. Tenets and techniques for clipping book. New York: Editorial Thieme, 2011; Cap 14:45-64.
5. Localization en Clinical Neurology. Capítulo 8. 6a edición. 2011:186-7.
6. Ojemann G, Heros R, Crowell R. Internal carotid artery aneurysms. In: Surgical Management of Cerebrovascular Disease, 2nd ed. Baltimore: Williams & Wilkins; 1988:179- 98.
7. Hashimoto N, Handa H, Nagata I, Hazama F. Experimentally induced cerebral aneurysms in rats. Part V. Relation of hemodynamics in the circle of Willis to formation of aneurysms. Surg Neurol 1980;13:41-5.
8. Nery B, Araujo R, Burjaili B, Smith T, Rodrigues J, Silva M. “True” posterior communicating aneurysms: Three cases, three strategies. Surg Neurol Int 2016;7:2.
9. Cid M. Cefaleas, evaluación y manejo inicial. Rev Med Clin Las Condes 2014;25:651-7
10. B Demaerschalk & DW Dodick. Recognizing sentinal headache as a premonitory symptom in patients with aneurysmal subarachnoid haemorrhage. Cephalalgia 2003;23:933-4.
11. Sanai N, Caldwell N, Englot DJ, Lawton MT. Advanced technical skills are required for microsurgical clipping of posterior communicating artery aneurysms in the endovascular era. Neurosurgery 2012;71:285-95.
12. Kaspera W, Majchrzak H, Kopera M, Ladzinski P. “True” aneurysm of the posterior communicating artery as a possible effect of collateral circulation in a patient with occlusion of the internal carotid artery. A case study and literature review. Minim Invasive Neurosurg 2002;45:240-4.
13. Soni S. Aneurysms of the posterior communicating artery and oculomotor paresis. J Neurol Neurosurg Psychiatry 1974;37:475-84.
14. Zheng F, Dong Y, Xia P, Mpotsaris A, Stavrinou P, Brinker G et al. ¿Is clipping better than coiling in the treatment of patients with oculomotor nerve palsies induced by posterior communicating artery aneurysms? A systematic review and meta-analysis. Clin Neurol Neurosurgery 2017;153:20-6.
15. Ahn J, Han I, Yoon P, Kim S, Kim N, Kim S et al. Clipping vs coiling of posterior communicating artery aneurysms with third nerve palsy. Neurology 2006;66:121-3.
16. Weiying Zhong, Ji Zhang, Jie Shen, Ping Zhang, Donghai Wang, Wandong Su et al. Posterior communicating aneurysm with oculomotor nerve palsy: Predictors of nerve recovery. J Clin Neurosci 2019;59:62-7.
Correspondencia:

Dr. Luis Contreras Seitz
 Departamento de Neurología y Neurocirugía, HCUCH
Departamento de Neurología y Neurocirugía, HCUCH
 [email protected]
[email protected]
 562 2978 8260
562 2978 8260