Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Alergia alimentaria a maní: conceptos clínicos, diagnósticos y terapéuticos
The prevalence of food allergy (FA) is about 2-8%, with clinical manifestations ranging from localized symptoms, to severe anaphylactic reactions. FA is generally caused by milk, eggs, soybeans, tree nuts, peanuts, wheat, fish and crustacean; being peanut one of the main foods involved in Western countries. Although in other parts of the world peanut allergy (PA) is not a problem, probably due to timing of introduction into the diet, form and preparation, genetics, and the hygiene hypothesis. Unfortunately, in Chile there are no epidemiological data about FA or PA. A number of food allergens have been identified, which has improved patient diagnosis and treatment assessment. Regarding peanut, 9 allergens have been identified, Ara h 1 to Ara h 9 (Arachis hypogaea). The diagnosis of IgE-mediated PA is based on a consistent history and evidence of peanut-specific IgE sensitization, carried out by skin-prick testing or in vitro determination. PA treatment consists of peanuts avoidance, which often becomes difficult due to inadvertent consumption. Today promising treatments are under development, including oral induction tolerance or sublingual immunotherapy. These treatments offer the possibility of at least raising the threshold of the amount of peanut that would be necessary to cause a life-threatening allergic reaction.
Rev Hosp Clin Univ Chile 2015; 26(4): 285-92.
Teresa Peralta C., Raquel Aguilera I., Rocío Tordecilla F., María Antonieta Guzmán M., Pablo Ferrer C.
La alergia alimentaria (AA) se define como una reacción clínica reproducible, mediada inmunológicamente, frente a la exposición a un alimento. Su prevalencia ha aumentado a nivel mundial en las últimas décadas(1), llegando a ser entre 5 - 8% en niños y entre 1 - 2 % en adultos(2).
Si bien maní, huevo, pescado, leche de vaca (LV), mariscos, soya y trigo, son los principales alimentos involucrados, la prevalencia es variable en distintos países del mundo(3). Un metaanálisis sobre los principales alimentos causantes de AA en Europa mostró una prevalencia de alergia a LV de 0,6%, huevo 0,2%, trigo 0,1%, soya 0,3%, maní 0,2%, nuez 0,5%, pescado 0,1% y mariscos 0,1%, siendo LV y huevo los más frecuentes en niños; mientras que maní, nuez, pescado y mariscos los más comunes en adolescentes y adultos(4). En cambio, en Norteamérica los principales alimentos alergénicos en niños fueron LV (2,2%), maní (1,8%), y nuez (1,7%), mientras que en adultos fueron mariscos (1,9%), frutas (1,6%), y vegetales (1,3%)(5). En Sudamérica y Chile no existen datos de prevalencia de AA, por lo que se extrapolan estudios de otros continentes. Sin embargo, en una reciente revisión de los test cutáneos realizados en el Centro de Alergias del Hospital Clínico Universidad de Chile (HCUCH), el maní fue uno de los alimentos con mayor frecuencia de sensibilización (datos no publicados).
FISIOPATOLOGÍA
La exposición inicial de un antígeno alimentario ocurre a nivel de la mucosa del tracto gastrointestinal,donde células epiteliales especializadastransfieren los antígenos alimentarios a células dendríticas que procesan estos antígenos en fragmentos peptídicos y los presentan en su superficie en contexto de moléculas de histocompatibilidad (MHC) clase II. Los péptidos son presentados a linfocitos T helper o cooperadores (LTh) vírgenes, activándolos.
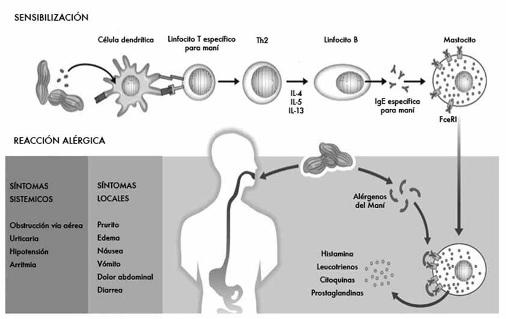
En individuos predispuestos genéticamente para patologías alérgicas, la activación de LTh resulta en la activación de un perfil Th2 con la consiguiente secreción de citoquinas (IL-4, IL-5 e IL-13) que estimularán a linfocitos B para la producción de inmunoglobulina E (IgE) específica contra péptidos del antígeno alimentario. La IgE específica se une a los receptores de IgE (FceRI) en la superficie de mastocitos y basófilos. Este proceso constituye la fase de sensibilización de la respuesta inmune. Posteriormente en la fase efectora, frente a la reexposición al antígeno, péptidos contenidos en éste se unen a dos IgE específicas, generando el entrecruzamiento de dos FceRI, lo que gatilla la activación de mastocitos y basófilos, y la liberación de varios mediadores inflamatorios entre los que destaca la histamina. Adicionalmente, las citoquinas producidas localmente reclutan y activan eosinófilos(6) (Figura 1).
Figura 1. Fisiopatología de la alergia alimentaria IgE mediada a maní.
Alérgenos vegetales
Los alérgenos son antígenos con capacidad de inducir una respuesta inmune específica con producción de IgE específica(6). La mayor parte de los alérgenos son proteínas o glicoproteínas.
Las fuentes de alérgenos contienen una mezcla de proteínas con potencial alergénico, de esta forma un paciente puede producir IgE contra uno o más alérgenos contenidos en una misma fuente. Se considera alérgeno mayor cuando hay reconocimiento por IgE en más del 50% de los individuos alérgicos a una fuente particular y menor si es reconocido por menos del 50%(7).
Para que una proteína se comporte como alérgeno alimentario debe tener un peso molecular de al menos 10 a 70 kDa y es necesario que sea estable frente al tratamiento térmico, pH ácido, acción enzimática del tubo digestivo y detergentes como las sales biliares; de manera que las moléculas intactas puedan alcanzar el sistema inmune intestinal e inducir una respuesta mediada por IgE(8-9).
La sensibilización primaria a alérgenos alimentarios ocurre principalmente por vía digestiva (alérgenos alimentarios tipo 1), pero también puede ocurrir por vía inhalatoria a partir de un aeroalérgeno mediante el mecanismo de reactividad cruzada (alérgenos alimentarios tipo 2). La reactividad cruzada consiste en que IgE específicas dirigidas contra un alérgeno en particular son capaces de reconocer moléculas estructuralmente homólogas provenientes de otra fuente(2).
Los alérgenos se denominan de acuerdo con su nombre taxonómico, usando las tres primeras letras del género, seguido de la primera letra de la especie y un número arábigo que corresponde al orden en el cual se van describiendo en el tiempo. Por ejemplo, en maní se denominan Ara h, del nombre científico Arachis hypogaea.
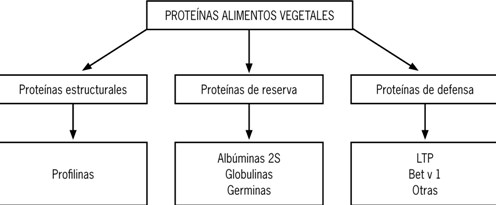
Los alérgenos vegetales se clasifican en familias y superfamilias, agrupándose según la homología de sus secuencias aminoacídicas, estructura y función. Familias cuyos miembros tienen baja homología, pero su estructura y función sugieren un origen filogenético común, se agrupan en superfamilias (Figura 2 y Tabla 1)(8).
Tabla 1. Familias y superfamilias de alérgenos vegetales
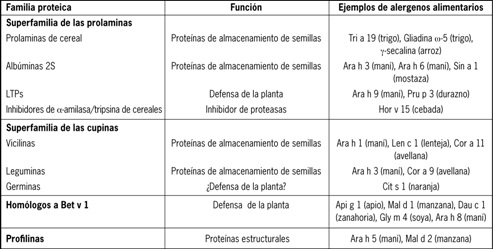
Figura 2. Grupos de proteínas alergénicas provenientes de vegetales.
Alérgenos de maní
El maní es una leguminosa, pero comúnmente se relaciona con frutos secos y, a pesar de ser taxonómicamente de familias diferentes, hasta el 50% de los pacientes con alergia a maní presentan sensibilización a frutos secos.
Se han descrito 9 alérgenos de maní, Ara h 1 a Ara h 9. Los alérgenos mayores del maní son Ara h 1 y Ara h 2 (proteínas de almacenamiento de semillas), mientras que Ara h 3, 4, 5, 6 y 7 son alérgenos minoritarios en la mayoría de las poblaciones estudiadas. Ara h 5 pertenece a la familia de las profilinas, Ara h 8 a los homólogos de Bet v 1 y Ara h 9 a las proteínas de transferencia lipídica (LTPs), siendo los 3 panalérgenos(10). Los panalérgenos vegetales son proteínas ampliamente extendidas en el reino vegetal, implicadas en funciones biológicas fundamentales de las plantas, con secuencias y estructuras altamente conservadas, por lo que son capaces de inducir fenómenos de reactividad cruzada(5).
MANIFESTACIONES CLÍNICAS E HISTORIA NATURAL
En la alergia IgE mediada a maní los síntomas aparecen desde segundos hasta 2 horas posterior a la ingesta(10). La cantidad de maní necesaria para inducir una respuesta alérgica es muy pequeña (100 a 1000 miligramos (mg)) e incluso algunos pacientes pueden reaccionar frente a la exposición vía cutánea o inhalatoria. Como referencia, un grano de maní contiene aproximadamente 200 mg de proteína(11).
La edad promedio de diagnóstico en niños es a los 14 meses y hasta el 75% de ellos presenta la primera reacción posterior a la primera ingesta conocida de maní, lo que destaca su rol como alérgeno oculto.
La mayor parte de las manifestaciones clínicas iniciales incluyen la piel (urticaria y/o angioedema); la mitad, vía respiratoria y sólo un tercio, tracto gastrointestinal. Los síntomas respiratorios pueden incluir síntomas de la vía aérea alta y baja, siendo el edema laríngeo, tos persistente, cambios en la voz y sibilancias los más importantes. Los síntomas gastrointestinales incluyen vómitos, dolor abdominal y diarrea(10).
En comparación con otros alérgenos alimentarios, el maní tiene la particularidad de provocar con mayor frecuencia anafilaxia severa potencialmente fatal. Es así como en el registro norteamericano de anafilaxia inducida por alimentos, el 63% de los episodios fatales fueron atribuidos a maní(11). Esto se debe a la alta estabilidad al calor y a la degradación digestiva que presentan los alérgenos de maní (fundamentalmente Ara h 2 y Ara h 6), lo cual los hace uno de los alérgenos alimentarios más potentes. Además, se ha observado que la anafilaxia severa se presenta con mayor frecuencia en adolescentes y adultos jóvenes con antecedentes de asma.
Cabe destacar que sólo el 20% de los niños con alergia a maní la resuelven al llegar a la edad escolar, siendo los pacientes con reacciones leves a moderadas y con menos alergias adicionales los que tienen mayores probabilidades de resolverla(12). Evitar la exposición al maní constituye la base del manejo de estos pacientes, lo que muchas veces es difícil de conseguir debido a lo extendido que está su uso, frecuentemente como alimento oculto en la industria alimenticia. Como consecuencia, la exposición accidental es muy común y puede poner en riesgo la vida de estos pacientes(13).
En AA en general y a maní en particular, se ha visto que el perfil molecular de sensibilización a alérgenos varía según el área geográfica estudiada. Por ejemplo, en Norteamérica los pacientes con alergia a maní están sensibilizados principalmente a Ara h 2, mientras que en países de Europa del norte (Suecia, Dinamarca, Alemania) están sensibilizados a Ara h 5 y a Ara h 8. En cambio, pacientes con alergia a maní de países mediterráneos (España e Italia), presentan sensibilización a Ara h 9(14).
Estudios han demostrado que el perfil de sensibilización a alérgenos de maní predice la evolución clínica y severidad de la AA a éste. Las reacciones más severas ocurren en pacientes con alergia a maní y sensibilización a Ara h 2 y/o Ara h 9. Ambas proteínas son resistentes a la digestión gástrica y a la cocción, lo cual las hace altamente alergénicas. Por otro lado, la sensibilización a Ara h 5 y Ara h 8 se relaciona principalmente a reacciones clínicas menores, como síndrome de alergia oral (SAO)(10).
DIAGNÓSTICO
Actualmente, tanto en Europa como Norteamérica, se cuenta con técnicas comerciales de diagnóstico molecular para la determinación clínica de los alérgenos alimentarios, inhalatorios y panalérgenos. Estas técnicas se basan en la medición de IgE sérica específica mediante ELISA individual o en formato de microarray, el cual permite detectar más de 100 IgE específicas diferentes(15). De esta forma se llega a un diagnóstico más certero de la AA, obteniéndose información respecto al pronóstico y posibles reactividades cruzadas que puede presentar el paciente(16). Así mismo, es posible mejorar en forma individual las indicaciones y recomendaciones para el paciente, dependiendo del componente molecular al que esté sensibilizado(15).
En Chile no se cuenta con estos ensayos diagnósticos y solo se dispone de extractos comerciales para test cutáneos y ELISA para detectar IgE específica a la fuente alergénica completa y algunos panalérgenos como LTP, profilina y Bet v 1. Ahora bien, está la posibilidad de realizar otras técnicas de laboratorio para identificar IgE específicas a nivel molecular, como el inmunoblot. Esta técnica serológica permite detectar IgE específicas dirigidas contra distintas bandas proteicas separadas por su peso molecular, lo cual orienta sobre la naturaleza del alérgeno. El inmunoblot es un procedimiento económico y factible de realizar en un laboratorio de inmunología de mediana complejidad, por lo que puede ser de gran utilidad implementar esta técnica con el fin de ampliar el conocimiento respecto al perfil de sensibilización de pacientes chilenos alérgicos a maní y precisar el diagnóstico y manejo de estos pacientes.
AVANCES TERAPÉUTICOS
Una vez confirmado el diagnóstico de AA a maní, el tratamiento se basa en restricción completa de su ingesta(12). Esta medida es mucho más compleja de lo que parece, ya que requiere una educación cuidadosa al paciente y su familia. Los productos alimenticios comerciales suelen indicar en el etiquetado la presencia de maní, pero se ha observado que hasta en un 25% de éstos se omite su presencia, especialmente en golosinas y productos de pastelería. La contaminación con trazas de maní no suele inducir reacciones en la mayoría de los pacientes, pero pacientes muy sensibilizados podrían reaccionar(11).
Como se mencionó anteriormente, el maní es una leguminosa, pero sus proteínas comparten homología estructural no sólo con otros leguminosas, sino también con frutos secos y semillas, como el sésamo. Actualmente se sabe que menos de un 5% de los pacientes alérgicos a maní presentarán alergia a otras leguminosas (soya, porotos verdes, arvejas y lupino), por lo que se espera que la mayoría de los pacientes las tolere. Por otro lado, respecto a los frutos secos, se observa alergia concomitante entre el 25-50% de los pacientes. Por esta razón y porque los frutos secos y el maní suelen procesarse juntos, se recomienda su restricción(12).
Debido a la severidad de las reacciones asociadas a la alergia a maní, su presencia como alimento oculto y porque ésta suele ser una alergia que persiste a lo largo de la vida, es que se han realizado diversos intentos en desarrollar terapias que induzcan tolerancia oral.
En contraste con la inmunoterapia subcutánea (ITSC) con aeroalérgenos y veneno de himenópteros, la ITSC con alérgenos alimentarios se ha asociado a una alta tasa de reacciones adversas, por lo que su uso no ha sido aprobado. Una alternativa es la inmunoterapia sublingual (ITSL). La ITSL para maní consiste en la administración de dosis crecientes de un extracto líquido de maní. Hasta la fecha se han publicado 2 estudios randomizados doble ciego controlados evaluando la seguridad y eficacia de la ITSL. En el primer estudio, 18 niños (rango de edad 1 – 11 años) completaron un esquema diario de ITSL con 2 mg de proteína de maní como dosis de mantención versus placebo. Como resultado, el grupo activo toleró en promedio hasta 1.700 mg de proteína de maní, mientras que el grupo placebo toleró en promedio 85 mg de proteína de maní. En el segundo estudio, 40 pacientes entre 12 y 37 años de edad, recibieron ITSL durante 68 semanas con una dosis de mantención de 1,38 mg de proteína de maní. Después de 44 semanas de ITSL, 14 de 20 pacientes (70%) toleraban dosis 10 veces mayores de proteína de maní que en un inicio, siendo la mayor parte de los efectos adversos menores confinados sólo a la mucosa oral(17).
Estudios clínicos recientes con inducción de tolerancia oral (ITO) han resultado prometedores. La ITO consiste en la administración diaria de dosis crecientes de maní por vía oral, comenzando con dosis inferiores a las que gatillan la reacción alérgica y llegando a dosis de mantención de hasta 4 gramos, dosis mucho mayores a las conseguidas con ITSL(17). El estudio randomizado controlado más importante de ITO, incluyó 99 niños (7 a 16 años de edad) con alergia a maní, quienes recibieron una dosis de mantención de 800 mg de maní durante 26 semanas. Los pacientes que finalizaron el protocolo aumentaron 25 veces el umbral de tolerancia. Los efectos adversos observados en la mayoría de los pacientes fueron leves y fácilmente tratables, sólo uno de ellos requirió uso de adrenalina(18). Estos resultados sugieren que la ITO es capaz de inducir desensibilización en más del 50% de los pacientes con alergia a maní y por consiguiente, previene reacciones frente a la exposición accidental a maní(17).
Por último, en los últimos años ha aparecido evidencia creciente acerca de la incorporación precoz de maní en la dieta de los niños como estrategia de prevención primaria para la alergia a maní. Esto se contrapone a las guías norteamericanas e inglesas de fines de los años noventa, que recomendaban la exclusión de alimentos alergénicos en la dieta de niños con alto riesgo de AA(19). Esta idea nace de la observación de que la prevalencia de alergia al maní es 10 veces mayor en niños judíos que viven en el Reino Unido (RU), que en niños judíos que viven en Israel. En RU los niños no consumen maní hasta después del año de vida, mientras que en Israel el maní es introducido en la dieta aproximadamente a los 7 meses de edad, lo que sugiere que la introducción precoz del maní podría jugar un rol protector en el desarrollo de alergia(19).
En esta misma línea, un estudio reciente publicado este año por Du Toit y colaboradores(20), realizado en 640 niños con alto riesgo de AA, mostró que la introducción precoz y mantenida de maní se asocia a una disminución significativa en el desarrollo de alergia a maní; en cambio, la evitación se asocia a mayor frecuencia de alergia al mismo. En respuesta a este estudio otros autores sugieren que la elevada exposición ambiental (como ocurre en países como China y E.E.UU) sería el factor clave en la sensibilización a maní, independiente de la exposición oral, proponiendo que en ausencia de exposición ambiental, la introducción precoz no sería relevante. De esta forma la discusión al respecto continúa abierta; sin embargo, este estudio abre nuevos horizontes en el enfrentamiento de la AA, siendo al parecer una buena estrategia la inducción de tolerancia oral a alimentos mejor que la evitación completa del alimento.
CONCLUSIONES
La AA es una enfermedad cada vez más prevalente, tanto en niños como adultos. Los alimentos implicados dependen de la aerobiología y costumbres alimenticias específicas de cada región, lo cual hace indispensable contar con estudios locales que caractericen tanto la prevalencia como las características clínicas de estos pacientes en cada región. En el Centro de Alergias del HCUCH se están desarrollando los primeros estudios de sensibilización y caracterización molecular en AA, lo cual contribuirá en forma significativa al conocimiento de estas enfermedades en nuestro país.
REFERENCIAS
1. Boyce JA, Assa’ad A, Burks AW, Jones SM, Sampson HA, Wood RA et al Guidelines for the diagnosis and management of food allergy in the United States: summary of the NIAID-sponsored expert panel report. Nutr
Res 2011;31:61-75.
2. Sicherer SH, Sampson HA. Foodallergy: epidemiology, pathogenesis, diagnosis, and treatment. J Allergy Clin Immunol 2014;133:291-307.
3. Burney PG, Potts J, Kummeling I, Mills EN, Clausen M, Dubakiene R et al. The prevalence and distribution of food sensitization in European adults. Allergy 2014;69:365-71.
4. Nwaru BI, Hickstein L, Panesar SS, Roberts G, Muraro A, Sheikh A. Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy 2014;69:992-1007.
5. Soller L, Ben Shoshan M, Harrington DW, Fragapane J, Joseph L, St Pierre Y et al. Overall prevalence of self-reported food allergy in Canada.
J Allergy Clin Immunol 2012;130:986-8.
6. Aalberse RC. Structural biology of allergens. J Allergy Clin Immunol 2000;106:228–38.
7. Stewart G, Zhang J, Robinson C. Thestructure and functionof allergens. Middleton’s allergy principle sans practice. 7th ed. Philadelphia:
Mosby, 2008.
8. Breiteneder H, Radauer C. A classification of plant food allergens. J Allergy Clin Immunol 2004;5:821-30.
9. Breiteneder H, Mills EN. Plant food allergensstructural and functional aspects of allergenicity. Biotechnology Advances 2005;23:395–9.
10. Burks AW. Peanut allergy. Lancet 2008;371:1538-46.
11. Sicherer S. Clinical update on peanut allergy. Ann Allergy Asthma Immunol 2002;88:350–61.
12. Sicherer SH, Sampson HA. Peanutallergy: emerging concepts and approaches for an apparent epidemic. J Allergy Clin Immunol 2007;120:491-503.
13. Nicolaou N. Allergy or tolerance in children sensitized to peanut: Prevalence and differentiation using component-resolved diagnostics. J Allergy Clin Immunol 2010;125:191-7.
14. Vereda A, van Hage M, Ahlstedt S, Ibañez MD, Cuesta-Herranz J, van Odijk J, et al. Peanutallergy: clinical and immunologic differences among patients from 3 different geographic regions. J Allergy Clin Immunol 2011;127:603-7.
15. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, Van Hage M, Baena-Cagnani CE et al. A WAO - ARIA - GA² LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J 2013;3;6:17.
16. Hauser M, Roulias A, Ferreira F, Egger M. Panallergens and their impact on the allergic patient. Allergy Asthma Clin Immunol 2010;18;6:1.
17. Bublin M, Breiteneder H. Developing therapies for peanut allergy. Int Arch Allergy Immunol 2014;165:179–94.
18. Anagnostou K, Clark A. Peanut immunotherapy. Clin Transl Allergy 2014;4:30.
19. Du Toit G, Graham Roberts, Peter H. Sayre, Henry T. Bahnson, Suzana Radulovic, Alexandra F. Santos et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med 2015;372:803-13.
Correspondencia:
 Dra. Raquel Aguilera Insunza
Dra. Raquel Aguilera Insunza
 Sección Inmunología, HCUCH
Sección Inmunología, HCUCH
 [email protected]
[email protected]
 562 2978 8567
562 2978 8567