Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Test cuantitativo sensorial en dolor
Pain is an unpleasant sensory and emotional experience, which is present in many diseases, and the central symptom of many of them. However, their diagnosis and evaluation methods have not changed much in the last century. Tools to quantitatively analyze this symptom and its underlying pathophysiological mechanisms are needed. The quantitative sensory test (QST) is a test done several decades ago for research purposes. However, in recent years, its use in different pain conditions have placed it as a tool to consider in evaluating a patient. The aim of this review is to provide information on the current performance of this test and its clinical applications development.
Rev Hosp Clin Univ Chile 2015; 26(2): 148-55.
Laura Domingues B., Ana Luisa Miranda M.
Usamos la palabra dolor para referirnos a una experiencia sensorial y emocional desagradable, asociada a una lesión tisular presente o potencial o descrita en términos de tal lesión(1). El dolor es transversal al género, la edad y la raza, y puede responder a incontables causas, siendo la principal manifestación de muchas patologías.
El dolor neuropático se define como aquel dolor originado como consecuencia directa de una lesión o enfermedad que afecta al sistema somatosensorial. El dolor neuropático puede originarse del daño de las vías nerviosas en cualquier punto desde las terminales nerviosas de los nociceptores periféricos a las neuronas corticales del cerebro(2).
También se ha descrito como un dolor anormal, mantenido en el tiempo por un procesamiento aberrante de la información sensorial, usualmente
severo, sin respuesta al tratamiento convencional(2). Se caracteriza clínicamente por la presencia de dolor, que puede o no seguir la distribución de un dermatoma o nervio periférico, asociado a síntomas positivos (alodinia, hiperalgesia, hiperestesia y parestesias) y a síntomas negativos (hipoestesia, anestesia, hipoalgesia y analgesia).
El diagnóstico de dolor en la actualidad es basado en la clínica, apoyado en algunas ocasiones con evidencia de daño estructural; sin embargo, el diagnóstico clínico provee información limitada con respecto a los mecanismos fisiopatológicos subyacentes al dolor, lo que dificulta un manejo adecuado del mismo(3). Faltan herramientas que permitan dilucidar la fisiopatología del dolor, así como predecir la evolución y la respuesta a los tratamientos ofrecidos. Esto convierte al manejo actual del dolor en un ensayo y error que en muchas ocasiones lleva a una respuesta insatisfactoria.
El test cuantitativo sensorial (TCS), o exploración cuantitativa sensorial, se refiere a un grupo de procedimientos que evalúan la respuesta perceptual de un individuo a estímulos sensoriales cuantificables aplicados en forma sistemática con el fin de caracterizar la función o disfunción sensorial del mismo(3). Esta prueba evalúa la totalidad del sistema, desde el receptor al cerebro y complementa a otros estudios electrofisiológicos, como la velocidad de conducción nerviosa, que sólo son capaces de evaluar la función de las fibras sensitivas gruesas. El TCS entrega información sobre las fibras A-beta mielinizadas gruesas, las fibras A-delta mielinizadas finas y las fibras C amielínicas finas, así como sus vías centrales. Sin embargo, no puede proveer información exacta sobre la fuente de la disfunción somatosensiorial(4).
El TCS se ha presentado en las últimas décadas como una herramienta de mucho interés en estudio del dolor, describiéndose su uso en la evaluación de los mecanismos que contribuyen al desarrollo y la mantención del dolor somático y neuropático, dolor post operatorio y el visceral(5-6). Así también se ha ampliado su uso a estudios que permiten predecir la respuesta analgésica, así como cuantificar la misma ante diferentes terapias(7-8).
Sin embargo, se debe tener en cuenta que este es un estudio que puede sufrir variaciones por el nivel de atención de los sujetos, su disposición a colaborar y la variabilidad del procedimiento. Es por eso que la realización del TCS requiere un examinador entrenado y el uso de protocolos estandarizados(9).
En el siguiente artículo se revisará el TCS y sus aplicaciones descritas en la actualidad para el diagnóstico y tratamiento del dolor.
MODALIDAD DE ESTÍMULOS Y TEJIDOS EVALUADOS EN EL TCS
Se pueden utilizar una amplia gama de estímulos diferentes durante la realización de esta prueba, que a su vez irán a evaluar distintos tipos de receptores, fibras nerviosas y vías centrales en cada caso. En este test se involucra además un nivel de procesamiento central que permite al individuo sentir, interpretar y reaccionar a los estímulos para que el examinador los interprete.
Las modalidades de estímulos frecuentemente utilizadas son: estímulos térmicos (frío o calor) y mecánicos (tacto, presión, vibración, etc.); sin embargo, también se pueden utilizar estímulos eléctricos, isquémicos y químicos(3).
Los estímulos térmicos son comúnmente aplicados sobre la superficie de la piel, utilizando elementos de Peltier. Estos son placas semiconductoras que producen un gradiente de temperatura entre la superficie superior e inferior mediante el paso de corriente eléctrica (Figura 1).
Figura 1. Placa de Peltier utilizada en la aplicación de estímulos térmicos sobre la piel.
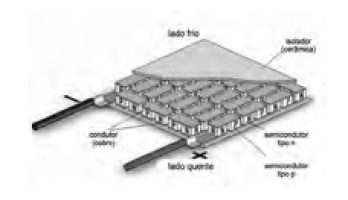
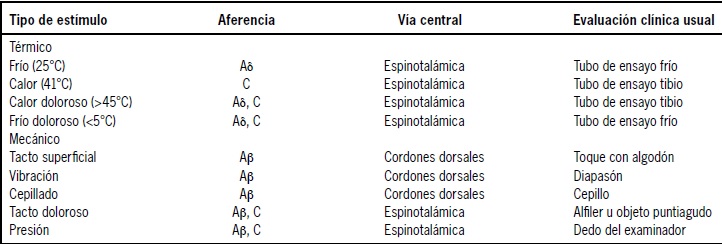
Pese a que en la mayor parte de protocolos de TCS los estímulos se aplican sobre la superficie de la piel, también se pueden usar otros tejidos como target, incluyendo músculos, cavidades del cuerpo (ejemplo: cavidad oral), órganos huecos (ejemplo: vejiga, recto y esófago) y genitales. Es así como existen modelos de TCS para la evaluación de dolor visceral donde se evalúa respuesta dolorosa del individuo ante la distención vesical o del recto, usando un balón inflable(11) (Tabla 1).
Tabla 1. Relación entre tipos de estímulos sensoriales, sus vías de transmisión y pruebas de evaluación clínica usual
MEDICIÓN DE LA RESPUESTA EN TCS
Tal como existen múltiples estímulos que se pueden aplicar en un protocolo de TCS, también existen múltiples medidas de respuestas que se pueden evaluar para caracterizar el funcionamiento del sistema somatosensorial en respuesta a estímulos sensoriales aplicados. Dentro de las respuestas evaluadas tenemos:
Respuestas perceptuales: esta evalúa la respuesta no dolorosa y busca obtener valores umbrales. Es decir, el punto de transición entre la ausencia de sensación y la primera sensación obtenida. Típicamente usada para evaluar la pérdida de función sensorial.
Respuestas dolorosas: se pueden evaluar umbrales dolorosos, es decir, la menor intensidad de estímulo que produce una respuesta dolorosa. Así también como tolerancia al dolor, lo que es la máxima intensidad de estímulo doloroso que el individuo está dispuesto o es capaz de tolerar.
Existen múltiples metodologías para la evaluación de los umbrales sensitivos, pero lo más comúnmente utilizado es la modalidad ascendente, en la cual se inicia un estímulo en muy baja intensidad y luego se va aumentando lentamente hasta el punto en que el paciente indica que empieza a sentirlo (umbral de percepción) o la sensación dolorosa (umbral doloroso). La limitante de este método es el tiempo de reacción del individuo. En individuos sanos se ha visto que el error producido por retraso de la conducción nerviosa es despreciable si se producen cambios lentos en la magnitud de los estímulos(12,13); sin embargo, el tiempo de reacción puede ser más importante en adultos mayores o el pacientes con atención fluctuantes, entre otros.
PRUEBAS DINÁMICAS EN TCS
Las evaluaciones de umbrales tanto sensitivos o dolorosos son llamadas pruebas pasivas del TCS; sin embargo, durante los últimos años ha aumentado mucho el interés en métodos que permiten evaluar la dinámica del procesamiento del dolor, tanto de la facilitación como de inhibición de la respuesta dolorosa. Estas respuestas son principalmente:
Sumación temporal: se refiere al aumento de la sensación dolorosa luego de la aplicación de una serie de estímulos nocivos a suficiente intensidad y frecuencia. Esta respuesta es una manifestación del wind-up. El fenómeno de wind-up se caracteriza por un aumento del potencial de acción luego de estímulos de baja frecuencia repetidos desde fibras C o nociceptores. Estas descargas repetidas hacen que se liberen en forma simultánea múltiples sustancias (glutamato, sustancia P, etc.) que a su vez van a activar receptores postsinápticos a nivel medular, desencadenando una mayor respuesta dolorosa(14,15). En esta prueba se aplican estímulos en una frecuencia de 0,3 Hz a una intensidad fija, la cual no es capaz de inducir wind-up en un sujeto sano.
Sumación espacial: se refiere a un aumento del área dolorosa con respecto el estímulo inicial. Es el resultado de la integración central de la información nociceptiva de múltiples aferencias periféricas y puede ocurrir en grandes áreas corporales. Esta integración entre múltiples estímulos dolorosos está presente tanto en el mismo dermatoma como en otros dermatomas(16,17).
Modulación del dolor condicionado (MDC): se refiere a la reducción del dolor producido por un estímulo nocivo cuando se aplica un segundo estímulo doloroso en un área corporal remota. Esta respuesta manifiesta la respuesta descendente inhibitoria (RDI) normal del sistema nervioso sano, en el cual la respuesta ascendente dolorosa que se produce por un estímulo nocivo desencadena una respuesta que se proyecta al asta dorsal de la médula(18). Este mecanismo utiliza opioides endógenos, así como serotonina y noradrenalina, y frecuentemente se ve alterado en individuos con dolor crónico.
PROTOCOLOS EN TCS
Debido al gran número de estímulos y pruebas que se pueden realizar para evaluar múltiples variables del sistema somatosensorial, el TCS puede convertirse en un examen poco aplicable a la clínica, ya que requiere mucho tiempo y colaboración del paciente. Es por ello que grupos como el German Research Network on Neuropatic Pain (DFNS) han desarrollado y validado una batería estandarizada para realizar un perfil de la función somatosensorial en áreas afectadas y en sanas(19,20). Estos protocolos siempre se basan en el examen del área afectada y la comparación con el segmento contralateral.
TCS EN DIAGNÓSTICO DE DOLOR
EL TCS ha mostrado un rol importante en el diagnóstico del dolor neuropático debido a su capacidad de cuantificar cambios en la función neural somatosensorial. El evaluar a un paciente con este tipo de dolor, el clínico intentará definir el área exacta de los síntomas sensitivos negativos y de los síntomas positivos, así como distinguir qué tipo de fibras están comprometidas. El contar con los 3 datos mencionados anteriormente, permite crear una unidad diagnóstica.
El TCS es una herramienta que permite evaluar y cuantificar las alteraciones somatosensoriales asociadas al dolor, teniendo como beneficio ante otras pruebas, la posibilidad de evaluar fibras finas y gruesas(21).
El dolor crónico es también una entidad que se beneficiaría del uso de una herramienta como el TCS. Esto se explica ya que en el proceso de cronificación del dolor, ocurren múltiples fenómenos como la sensibilización central y la alteración de la RDI, entre otros, que pueden demostrarse con esta herramienta.
Un estudio realizado en pacientes con artritis de rodilla evidenció un aumento significativo en el fenómeno de sumación temporal en rodilla y en el tibial anterior, al comparar pacientes con dolor crónico con controles(22). En forma similar, se ha visto que pacientes con fibromialgia requieren una menor frecuencia de estímulos que un sujeto sano para que se desencadene el fenómeno temporal(23). Esta respuesta respondería al fenómeno de sensibilización central.
TCS EN LA PREDICCIÓN DEL DESARROLLO DEL DOLOR
Una de las aplicaciones que se han descrito para esta prueba en los últimos años, es la capacidad de predecir cuáles pacientes evolucionarán hacia el desarrollo de un dolor más intenso luego de estímulos o traumas.
En un estudio prospectivo, realizado a pacientes que sufrieron accidentes vehiculares con lesión cervical tipo latigazo, se observó que aquellos que
desarrollaron un dolor cervical de larga data (12 semanas) tenían un menor umbral de dolor por frío en TCS realizado una semana post accidente(24). Otro estudio describió en un grupo de pacientes que debían someterse a una toracotomía en forma electiva, que aquellos que presentaban una mayor sumación temporal ante estímulos mecánicos en tórax, desarrollaban mayor dolor en el período postoperatorio(25).
Esto nos presenta una herramienta que permite orientar mejor las estrategias de manejo del dolor entre los muchos pacientes sometidos a estímulos nocivos similares.
TCS EN LA PREDICCIÓN DE LA RESPUESTA A TERAPIA ANALGÉSICA
Uno de los principales problemas que existe hoy en el manejo del dolor es la carencia de evidencia que permita distinguir cuáles pacientes se beneficiarán del uso de una terapia de quiénes no. Es por eso que tenemos en la actualidad un gran número de pacientes que se someten a terapias con múltiples fármacos, con todas sus complicaciones asociadas, antes de poder llegar al medicamento que permita aliviar sus molestias. Este mecanismo de prueba y error es no solo poco costo efectivo, sino que en algunos casos es incluso peligroso para la salud de
los pacientes.
Estudios realizados con TCS en múltiples patologías muestran su capacidad de predecir respuesta a ciertos fármacos según los resultados obtenidos en esta prueba. Un estudio realizado en pacientes con neuralgia post herpética mostró que los valores umbrales de dolor por calor predicen la respuesta a terapia con opioides, pero no respuesta a amitriptilina(26). También se ha observado que en pacientes con neuropatía diabética dolorosa, una baja CPM demostrada al TCS se relaciona con mejor respuesta al tratamiento con duloxetina(27).
Estudios han mostrado además que en pacientes con artrosis de rodilla que se someten a artroplastía total de rodilla, se logra una normalización de su CPM demostrado al TCS(28). Esto nos permite considerar el TCS como una herramienta útil en el monitoreo de los pacientes sometidos a terapias analgésicas para evaluar la respuesta a las mismas.
CONCLUSIÓN
Pese a los muchos años de estudio de la medicina, el dolor, tanto su diagnóstico como tratamiento, sigue siendo un gran desafío para los médicos. El TCS es una herramienta, que pese a existir desde hace ya varias décadas, recientemente ha encontrado una gran variedad de aplicaciones en dolor.
Aún faltan estudios que permitan estandarizar los protocolos que sean aplicables a la clínica y establecer tablas de valores normales en población sana; sin embargo, existe un amplio interés en la comunidad científica por este tema y muchos grupos alrededor del mundo se encuentran investigando al TCS como herramienta clave en el diagnóstico y manejo de múltiples patologías como el dolor neuropático, la fibromialgia, la artrosis y el lumbago, entre otros.
Contar con un examen que permita cuantificar aspectos del dolor, que durante tantos años han sido sólo evaluados cualitativamente, abre una puerta en el conocimiento de la fisiopatología del mismo. El TCS se presenta como una herramienta que podría ayudar en el desarrollo de estrategias de manejo del mismo que sean enfocados al mecanismo que lo ocasiona, evitando malestar al paciente.
REFERENCIAS
1. H. Merskey and N. Bogduk, editors. Classification of Chronic Pain. Seattle: IASP Press, 1994.
2. Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, et al. Neuropathicpain: redefinition and a grading system for clinical and research purposes. Neurology 2008;70:1630-5.
3. Cruz-Almeida Y, Fillingim B. Review article: can quantitative sensory testing move us closer to mechanism-based pain management? Pain Medicine 2014;15:61–72
4. Arendt-Nielsen L, Yarnitsky D. Experimental and clinical applications of quantitative sensory testing applied to skin, muscles and viscera. J Pain 2009;10:556–72.
5. Gottrup M, Andersen J. Psychophysical examination in patients with post-mastectomy pain. Pain 2000;87:275-84.
6. Olesen SS, van Goor H, Bouwense SA, Wilder-Smith OH, Drewes AM. Reliability of statistic and dynamic quantitative sensory tensting in patients with painful chronic pancreatitis. Reg Anesth Pain Med 2012;37:530-6.
7. Schiff E, Eisenberg E. Can quantitative sensory testing predict the outcome of epidural steroid injections in sciatica? A preliminary Study. Anesth Analg 2003;97:828-32.
8. Kosek E, Ordeberg G. Abnormalities on somatosensory perception in patients with painful osteoarthritis normalize following successful treatment. Eur J Pain 2000;4:229-38.
9. Grosen K, Fischer I, Olesen A, Drewes AM. Can quantitative sensory testing predict responses to analgesic treatment? Eur J Pain 2013;17:1267-80.
10. Backonja M, Attal N, Baron R, Bouhassira D, Drangholt M, Dyck PJ et al. Value of quantitative sensory testing in neurological and pain disorders. Pain 2013;154:1807–19.
11. Bouin M, Plourde V, Boivin M, Riberdy M, Lupien F, Laganière M et al. Rectal distention testing in patients with irritable bowel syndrome: Sensitivity, specificity, and predictive values of pain sensory thresholds. Gastroenterology 2002;122:1771–7.
12. Yarnitsky D, Ochoa J. Studies of heat pain sensation in man: Perception thresholds, rate of stimulus rise and reaction time. Pain 1990;40:85–91.
13. Yarnitsky D, Ochoa J. Differential effect of compression-ischaemia block on warm sensation and heat-induced pain. Brain 1991;114(Pt 2):907–13.
14. Cabrera M. Astudillo M. Dolor agudo postoperatorio: cómo el proceso quirúrgico induce neuroplasticidad. Revista El Dolor 2007;48:30-4.
15. Price DD. Characteristics of second pain and flexion reflexes indicative of prolonged central summation. Exp Neurol 1972;37:371–87.
16. Quevedo A, Coghill R. Filling-in, spatial summation, and radiation of pain: Evidence for a neural population code in the nociceptive system; J Neurophysiol 2009;102:3544–53.
17. Staud R, Price D, Robinson M, Mauderli AP, Vierck CJ. Maintenance of windup of second pain requires less frequent stimulation in fibromialgia patients compared to normal controls. Pain 2004;110:689–96.
18. Le Bars D. The whole body receptive field of dorsal horn multireceptive neurons. Brain Res Brain Res Rev 2002;40:29–44.
19. Rolke R, Magerl W, Campbell K, Schalber C, Caspari S, Birklein F et al. Quantitative sensory testing: A comprehensive protocol for clinical trials. Eur J Pain 2006;10:77–88.
20. Rolke R, Baron R, Maier C, Tölle TR, Treede RD, Beyer A. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): Standardized protocol and reference values. Pain 2006;123:231–43.
21. Arendt-Nielsen L, Yarnitsky D. Experimental and clinical aplications of quantitative sensory testing aplied to skin, muscles and viscera. J of Pain 2009;6:556-72.
22. Arendt-Nielsen L, Graven-Nielsen T. Translational musculoskeletal pain research. Best Pract Res Clin Rheumatol 2011;25:209–26.
23. Taud R, Robinson ME, Price DD. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain 2007;8:893–901.
24. Kasch H, Qerama E, Bach FW, Jensen TS. Reduced cold pressor pain tolerance in non-recovered whiplash patients: A 1-year prospective study. Eur J Pain 2005;9:561–9.
25. Weissman-Fogel I, Granovsky Y, Crispel Y, Ben-Nun A, Best LA, Yarnitsky D et al. Enhanced presurgical pain temporal summation response predicts post-thoracotomy pain intensity during the acute postoperative phase. J Pain 2009;10:628–36.
26. Edwards RR, Haythornthwaite JA, Tella P, Max MB, Raja S. Basal heat pain thresholds predict opioid analgesia in patients with postherpetic neuralgia. Anesthesiology 2006;104:1243–8.
27. Yarnitsky D, Granot M, Nahman-Averbuch H, Khamaisi M, Granovsky Y. Conditioned pain modulation predicts duloxetine efficacy in painful diabetic neuropathy. Pain 2012;153:1193–8.
28. Graven-Nielsen T, Wodehouse T, Langford RM, Arendt-Nielsen L, Kidd BL. Normalization of widespread hyperesthesia and facilitated spatial summation of deep-tissue pain in knee osteoarthritis patients after knee replacement. Arthritis Rheum 2012;64:2907–16.
Correspondencia:
 Dra. Laura Domingues Botelho
Dra. Laura Domingues Botelho
 Servicio Medicina Física y Rehabilitación, HCUCH
Servicio Medicina Física y Rehabilitación, HCUCH
 [email protected]
[email protected]
 562 2978 8040
562 2978 8040