Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Hallazgos imagenológicos en la enfermedad pleuropulmonar asociada al asbesto
Abestos-related pleuropulmonary disease involves a number of pathologic conditions that share inhalation exposure to asbestos fibers as a common factor. Dose and time of exposure have a role in the clinical manifestations of it, the main ones being benign pleural disease, asbestosis, malignant mesothelioma and bronchogenic carcinoma. Despite the ban on asbestos material usage in Chile, there is a long latency between exposure and clinical manifestations, which lead to it being still a relevant public health issue to this day. We present a series of representative images of abestos-related pleuropulmonary disease diagnosed at our centre. The pathogeny and radiologic manifestations are discussed, with an emphasis on the latter.
Rev Hosp Clin Univ Chile 2016; 27(1): 35-45
José Weisz C., Daniel Hasson A., Tamara Palavecino B.
El término asbesto es usado para referirse genéricamente a un grupo particular de silicatos minerales con gran resistencia tensil, química, térmica y una gran flexibilidad, características que han propiciado su amplio abanico de uso en el mundo(1). Durante su procesamiento se fragmenta en fibras microscópicas que al ser inhaladas en concentraciones suficientes para sobrepasar los mecanismos de clearance pulmonar, generan los efectos nocivos que serán descritos más adelante, configurando la enfermedad pleuropulmonar relacionada al asbesto (EPPA)(2).
A pesar de la prohibición de su uso en los países industrializados, en algunos países en vías de desarrollo sigue siendo utilizado con la consiguiente alta exposición al asbesto. Se estima que más de 107.000 personas mueren al año por las enfermedades relacionadas a su exposición(3).
En Chile se usó en grandes cantidades como material de construcción y para fabricación de cañerías, entre otros. Desde enero de 2001 se prohíbe la producción, importación, distribución, venta y uso de este material para construcción. Desde el punto de vista legal, la EPPA es considerada una enfermedad ocupacional respiratoria(4). Es de esperarse que persista esta alerta, siendo un problema de salud pública relevante por la gran latencia entre exposición e inicio de síntomas(5). Actualmente la información epidemiológica respecto a la EPPA en Chile es escasa debido a las limitaciones inherentes a depender de fuentes de información tales como reportes de certificados de defunción y vigilancia médica(6,7).
Los procesos fisiopatológicos que subyacen la EPPA no están del todo claros. Las alteraciones patológicas están determinadas por diversos factores, incluyendo la dosis de exposición, el tipo de fibra de asbesto, su tamaño, las características físicas y su capacidad de producir una reacción por parte del organismo y la susceptibilidad genética del individuo afectado(8,9). La acumulación y persistencia de fibras de asbesto en el organismo gatilla una reacción inflamatoria que genera pérdida del epitelio alveolar (tanto por mecanismos de lisis como de apoptosis), proliferación fibroblástica (reacción que se explicaría por la gran liberación de factores de crecimiento por parte de los macrófagos ante una fagocitosis ineficaz) y el posterior depósito de fibras de colágeno(10,11). El tamaño de las fibras de asbesto inhaladas también es un factor relevante dentro de la fisiopatología, dado que las fibras pequeñas son más fácilmente depuradas que las fibras de mayor tamaño(12). En general las fibras >10um son consideradas las más carcinogénicas y las fibras >20 um se relacionan con asbestosis pulmonar(9). Actualmente se postula que el estrés oxidativo producido por la interacción de las fibras de asbesto y el organismo cumplirían un rol central en los mecanismos moleculares de la toxicidad pulmonar en la EPPA, llevando a la inflamación crónica, fibrosis pulmonar y mutagénesis(8).
La EPPA engloba básicamente 4 entidades(13): (1) enfermedad pleural benigna, (2) asbestosis, (3) mesotelioma maligno y (4) carcinoma broncógeno. Los hallazgos imagenológicos en las distintas modalidades son centrales en el diagnóstico, siendo la tomografía computada de alta resolución (TCAR) la herramienta de mayor utilidad en estos casos(2,14).
Sobre el tamizaje de la EPPA clásicamente se ha realizado mediante un sistema estandarizado de radiografía: el International Classification of Radiographs of Pneumoconiosis (sistema ILO)(11); sin embargo, en los últimos años el potencial rol de la TCAR en el tamizaje ha ido cobrando relevancia por su mayor capacidad de detectar hallazgos de asbestosis(15). Se han propuesto sistemas análogos al ILO en el caso de la tomografía computada (TC)(16), pero ninguno ha sido adoptado ampliamente(11). Además se ha evaluado el rol del uso de la tomografía en la detección temprana de mesotelioma. Al respecto, existen ensayos clínicos actualmente en curso(17).
En nuestro centro, la pesquisa de cuadros clínicos con historia de exposición y hallazgos radiológicos compatibles con EPPA continúa siendo parte de la práctica radiológica habitual. Se hará una revisión de la EPPA, poniendo el énfasis en los hallazgos radiológicos característicos a partir de casos pesquisados en nuestro departamento que tienen en común la historia de exposición a asbesto.
ENFERMEDAD PLEURAL BENIGNA RELACIONADA AL ASBESTO
Dentro de la EPPA, la afectación pleural predomina por sobre el compromiso del parénquima. Se postula que la pleura es más sensible a las fibras de asbesto(18).
Derrame pleural
La EPPA generalmente tiene largos periodos de latencia con la excepción del derrame pleural benigno que puede aparecer entre un año a 20 años posterior a la primera exposición(2). En general el compromiso es unilateral, si bien en ocasiones puede ser bilateral o manifestarse en el lado contralateral posterior a la resolución. El derrame pleural como manifestación imagenológica aislada de la EPPA es indistinguible de otras causas de derrame pleural(13), siendo fundamental un alto índice de sospecha ante una historia de exposición.
Placas pleurales
Las placas pleurales localizadas están constituidas por áreas de fibrosis que se desarrollan a partir de la pleura parietal; sin embargo, en algunos casos pueden afectar la pleura visceral, en cuyo caso suele haber compromiso del parénquima pulmonar subyacente(13). Se postula que una exposición relativamente baja al asbesto puede inducir la formación de placas pleurales localizadas, mientras que el compromiso pleural difuso estaría relacionado con una mayor exposición(19).
En la radiografía de tórax las placas pleurales se observan como engrosamientos pleurales focales (Figura 1 y 2) que se originan en la superficie interna de las costillas, extendiéndose a lo largo de músculos intercostales adyacentes. En la proyección anteroposterior las placas se ubican en la pared posterolateral entre la séptima y décima costilla, en la pared lateral entre la sexta y novena costillas, el domo del diafragma (hecho considerado casi patognomónico) y la pleura mediastínica(13).
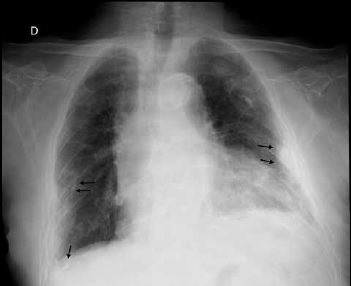
Figura 1. Radiografia de tórax proyección anteroposterior de paciente con historia de exposición a fibras de asbesto. Se observan multiples placas pleurales (flechas negras) algunas con calcificaciones en su interior, asociado a un patrón reticular mayor hacia las bases lo que sugiere enfermedad pleuropulmonar relacionada al asbesto.
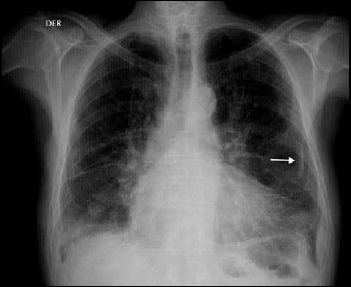
Figura 2. Radiografía de tórax proyección postero-anterior de paciente con historia de exposición a fibras de asbesto. Se observan opacidades pleurales focales que impresionan calcificadas (flecha blanca) y un patrón intersticial retículo nodular mayor hacia las bases, asociado a mala definición de las cúpulas diafragmáticas y de los contornos cardiacos. Hallazgos compatibles con enfermedad pleuropulmonar relacionada al asbesto.
Los hallazgos en TC suelen corroborar la distribución, pero entrega mejor definición de las placas y logra pesquisar placas no visibles por medio de radiografías convencionales principalmente en zonas anteriores y paravertebrales. Un 15% de los casos presenta calcificaciones asociadas(20).
El reconocimiento de la distribución de las placas pleurales es fundamental, ya que la presencia de placas pleurales secundario a procesos infecciosos previos es un hallazgo relativamente frecuente; sin embargo, estas suelen ubicarse en los ápices pulmonares, ubicación que en el compromiso pleural relacionado al asbesto es excepcional(2) (ver Figura 3).
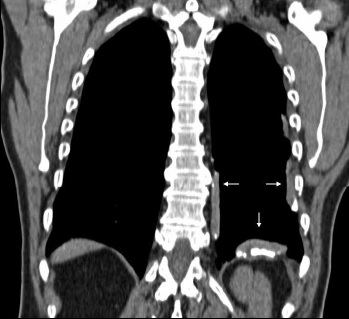
Figura 3. Reconstrucción coronal TC de tórax. Se observan al menos tres placas pleurales con calcificaciones en su interior (flechas blancas). La ubicación diafragmática es considerada casi patognomónica de la enfermedad (flecha blanca vertical). Nótese el respeto de los ángulos costo frénicos, hecho que apoya el diagnóstico de placas pleurales.
Engrosamiento pleural difuso
A diferencia de las placas pleurales localizadas, engrosamiento pleural difuso se inicia a partir de la pleura visceral y su posterior fibrosis. Requiere una exposición a mayores dosis de asbesto y se relaciona con alteraciones funcionales del tipo restrictivas sin haber necesariamente compromiso del parénquima pulmonar subyacente. Es un hallazgo menos específico que las placas pleurales localizadas para el diagnóstico de EPPA, dado que ocurre en múltiples otras condiciones, tales como infecciones previas, secundario a hemotórax o a algunas enfermedades del tejido conectivo(18).
La diferenciación imagenológica entre placas pleurales y compromiso pleural difuso puede ser dificultosa; sin embargo, ciertos hallazgos son orientadores. La extensión de las placas localizadas no suele sobrepasar cuatro espacios intercostales y característicamente respetan los ángulos costofrénicos, lo que no siempre se cumple para el engrosamiento pleural difuso, el que suele ser de bordes irregulares y de menor definición que las placas pleurales y al ser un proceso que afecta la pleura visceral, a veces se extiende a través de las cisuras(21). La presencia de calcificaciones también es de utilidad, siendo excepcional en el compromiso pleural difuso(18).
En la radiografía de tórax se observa como un suave e ininterrumpido engrosamiento pleural que se extiende al menos a través de un cuarto de la pared torácica.
La TC es más sensible y específica para la detección de engrosamiento pleural difuso(22) y permite diferenciar el engrosamiento pleural difuso benigno de un proceso neoplásico subyacente. Son signos orientadores, pero no específicos de malignidad un engrosamiento de aspecto nodular, el tamaño mayor de 1 cm, el compromiso de la pleura mediastínica y el compromiso circunferencial del hemitórax o pleural rind (S 41% y E 100%)(23).
Atelectasias redondas
Las atelectasias redondas son un tipo especial de engrosamiento pleural menos frecuente que los otros tipos de engrosamiento pleural relacionados al asbesto. También son conocidas como síndrome de Blesovsky o folded lung(24).
Se observan como opacidades similares a masas cercanas a la superficie pleural, que presentan una imagen curvilínea en su interior con aspecto de cola, determinando su hallazgo radiológico más característico: el signo de la “cola de cometa”(2). El mecanismo de formación de las atelectasias redondas es a partir de una reacción inflamatoria pleural local que conlleva a fusión y engrosamiento de ambas superficies pleurales, generando compresión del parénquima pulmonar subyacente y finalmente plegamiento de la pleura sobre el pulmón(2). En la radiografía de tórax se observan como masas periféricas con o sin compromiso del parénquima pulmonar subyacente(13) y en TC su aspecto está determinado por tres hallazgos: masa redondeada u ovalada de entre 2,5-7 cm, contactando la superficie pleural, presencia de una estructura lineal en forma de cola en su interior correspondiente con los elementos broncovasculares y engrosamiento de la pleura subyacente. Puede haber pérdida del volumen pulmonar(23) (ver Figura 4). Es importante diferenciar una atelectasia redonda de un carcinoma broncogénico, ya que su aspecto imagenológico puede ser similar. Muchas veces es útil ampliar el estudio con ultrasonografía y si persiste la duda diagnóstica, con PET/CT(25).
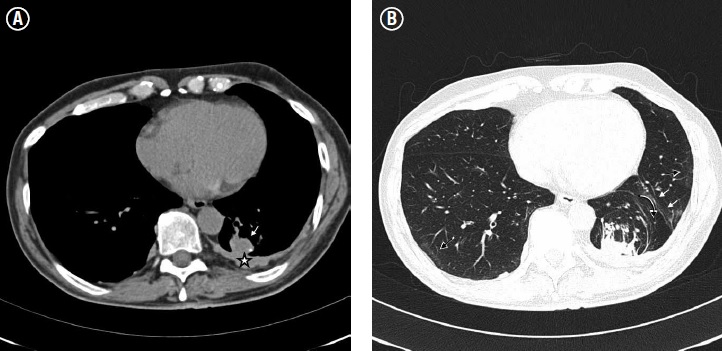
Figura 4. Cortes axiales seleccionados de TC de tórax. (A) Se observa una masa de forma circular que contacta con la pleura (flecha blanca) la cual se encuentra a su vez engrosada (estrella). (B) Los elementos broncovasculares generan el aspecto de pulmón plegado (flecha negra curva) y se observa una banda parenquimatosa (flechas blancas). Nótese el aspecto en vidrio esmerilado de distribución subpleural, sugerente de asbestosis (flechas negras).
ASBESTOSIS
Asbestosis se define como la fibrosis intersticial difusa del parénquima pulmonar secundaria a la exposición a asbesto(19). A pesar de la alta coexistencia entre asbestosis y enfermedad pleural relacionada al asbesto, la asbestosis debe ser comprendida como una entidad diferente, dado que posee diferente epidemiología, clínica y pronóstico(23) y equiere mayores dosis de exposición para desarrollarse, existiendo relación entre el grado de exposición y la severidad de la fibrosis pulmonar(13). El hábito tabáquico es considerado un factor de riesgo para el desarrollo de asbestosis, pero no para el desarrollo de afección pleural relacionada al asbesto(26).
Las alteraciones imagenológicas producidas por la asbestosis pulmonar predominan en los lóbulos inferiores, siguiendo distribución subpleural y en algunos casos pueden extenderse hasta el lóbulo medio y língula. Los lóbulos superiores pueden estar afectados en etapas avanzadas de la enfermedad(13). Los hallazgos presentes en la asbestosis no son específicos, estando presentes en otras causas de fibrosis pulmonar. En ese sentido la sospecha ante la historia de exposición es clave. La panalización del parénquima pulmonar se encuentra en un 7-17% de los casos(27).
En la radiografía de tórax suele observarse un patrón retículo-nodular y en vidrio esmerilado predominantemente en zonas inferiores asociado a mala definición de las cúpulas diafragmáticas y los contornos de la silueta cardiaca (Figura 1). En la enfermedad avanzada puede observarse pérdida del volumen pulmonar(23). En un 80% de las radiografías de tórax, coexisten hallazgos de asbestosis con enfermedad pleural relacionada al asbesto, porcentaje que asciende a 100% en TCAR(27) (ver Figura 1 y 2).
En la TC los hallazgos varían en función de la progresión de la enfermedad. En etapas tempranas se observan opacidades curvilíneas subpleurales que se disponen de manera paralela a la superficie pleural y representan fibrosis peribronquiolar, opacidades en banda lineales de 2-5 cm de longitud que se disponen de manera radial en el parénquima y que suelen contactar la superficie pleural (“bandas parenquimatosas”), bronquiectasias por tracción, imágenes quísticas, vidrio esmerilado, nódulos, engrosamiento de los septos interlobulillares y patrón en “panal de abejas” que suelen distribuirse de manera subpleural. Los hallazgos más frecuentes encontrados son el engrosamiento de los septos interlobulillares (84%) y las bandas parenquimatosas (76%)(28) (ver Figura 5).
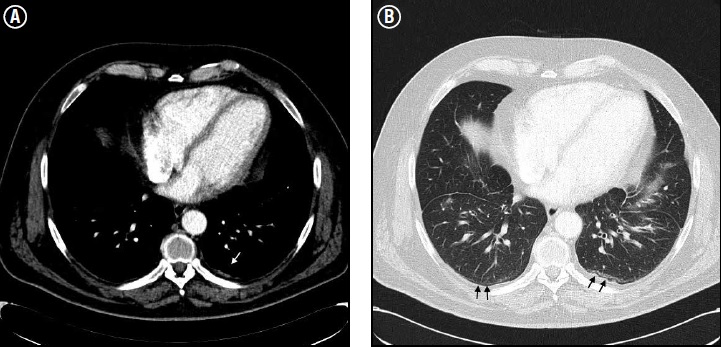
Figura 5. Cortes axiales de TC de torax. (A) Se observan placas pleurales (flecha blanca). (B) Compromiso del parenquima pumonar subyacente representado por opacidades subpleurales curvilineas (flechas negras) lo que sugiere fibrosis peribronquiolar.
MESOTELIOMA MALIGNO PLEURAL
El mesotelioma maligno es una neoplasia proveniente de células de la superficie mesodérmica de la cavidad celómica embrionaria que dan origen al pericardio, a la túnica vaginalis, al peritoneo y a la pleura, siendo esta última la localización más frecuente de esta neoplasia (más del 90%)(29) y en cuyo caso es llamada mesotelioma pleural maligno (MPM). El MPM es la segunda neoplasia más frecuente en pleura luego de los implantes secundarios, existiendo una gran asociación (hasta 80%) con historia de exposición a asbesto(30). Es considerada una neoplasia rara y de mal pronóstico(31). La incidencia en pacientes expuestos laboralmente a asbesto es de aproximadamente un 10% y suele presentarse en pacientes de entre 50-70 años, siendo más común en hombres con una relación 4:1(32). Las imágenes son centrales en el planteamiento diagnóstico y suelen ser la primera herramienta diagnóstica ante la sospecha de MPM. Además son fundamentales en la etapificación y en la decisión terapéutica; sin embargo, el diagnóstico de certeza requiere confirmación histológica(32).
En la radiografía de tórax puede observarse derrame pleural unilateral, siendo el hallazgo más frecuente (hasta un 80% de los casos)(30). Son hallazgos característicos el engrosamiento pleural difuso, nodular o lobulado (60%), masas pleurales (45-60%)(33) y el ensanchamiento mediastínico, lo que puede indicar presencia de adenopatías. Puede haber extensión hacia las cisuras interlobares y en etapas avanzadas observarse desplazamiento del mediastino hacia el lado afectado asociado a disminución de los espacios intercostales(30).
La TC es la modalidad de elección para evaluar el MPM. Demuestra la extensión del tumor, la posible invasión local, adenopatías asociadas y diseminación a distancia y es una herramienta suficiente para etapificar y definir el tratamiento. Son hallazgos característicos el derrame pleural unilateral (74%) y el engrosamiento pleural (92%) que puede ser nodular o lobulado(34). Un engrosamiento pleural circunferencial, nodular y de más de 1 cm de espesor, es altamente sugerente de malignidad. Puede observarse extensión hacia el mediastino, compromiso pericárdico (manifestado por derrame pericárdico y engrosamiento del pericardio) e invasión a la pared torácica (representado por invasión intercostal y pérdida de tejido graso extrapleural), siendo difícil de determinar la invasión transdiafragmática(30) (ver Figura 6).
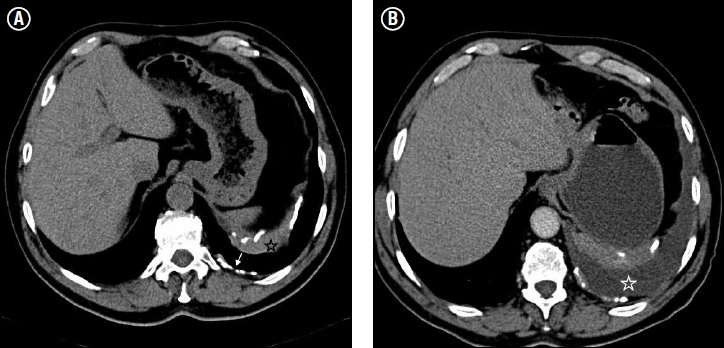
Figura 6. Cortes axiales seleccionados de TC. (A) Se observa un gran engrosamiento pleural > 1cm (estrella negra) y algunas placas pleurales (flechas) con calcificaciones en su interior. (B) Mismo paciente 3 años después. Se observa derrame pleural izquierdo asociado (estrella blanca). El gran engrosamiento asociado a la aparición de derrame pleural debe hacer sospechar la presencia de mesotelioma pleural maligno (MPM).
En ocasiones se observa diferenciación osteocartilaginosa al interior de los engrosamientos, debiendo ser diferenciada de las calcificaciones observadas en patología pleural benigna relacionada al asbesto.
El tumor es considerado irresecable si es multifocal o si existe invasión difusa de la pared torácica, del pericardio, de la pleura contralateral o si hay compromiso transdiafragmático(35). Puede haber adenopatías mediastínicas y otras adenopatías intratorácicas y presencia de enfermedad metastásica pulmonar o presencia de linfangitis carcinomatosa. En casos en que el límite de la invasión es dudoso en TC, estudios adicionales con PET-CT definen de mejor manera la invasión de estructuras(30).
CARCINOMA BRONCÓGENO
El carcinoma broncogénico es la principal causa de muerte por cáncer en el mundo (es responsable de casi 1 de cada 5 muertes por cáncer(35)), siendo un tema extenso y que excede los objetivos de este trabajo. Para una actualización en cuanto su correlación clínico radiológica se recomienda la revisión de Rosado-de-Chistenson(37). Existe una clara relación entre la exposición al asbesto y el desarrollo de carcinoma broncogénico, teniendo un periodo de latencia entre exposición y desarrollo de la neoplasia muy variable y existiendo casos que ocurren en menos de 10 años y reportes de otros que ocurrieron luego de más de 50
años(13). Son tumores que suelen ubicarse en la periferia del parénquima pulmonar, distribuyéndose principalmente en lóbulos inferiores, lo que se correlaciona con la distribución característica de la asbestosis(23). Se estima que un 20-25% de los trabajadores expuestos a cantidades elevadas de asbesto desarrollarán carcinoma broncogénico(38). El pronóstico es similar al del carcinoma broncogénico no relacionado a la exposición de asbesto; sin embargo, la posible coexistencia de asbestosis o enfermedad pleural asociada podría incidir en la funcionalidad posterior al tratamiento quirúrgico.
DISCUSIÓN
La exposición a fibras de asbesto genera alteraciones tanto en el parénquima pulmonar como en pleura, las que pueden ser categorizadas a grandes rasgos como neoplásicas y no neoplásicas. Estas, en su conjunto, constituyen la EPPA la cual en sus diversas manifestaciones es considerada una enfermedad ocupacional.
La EPPA persistirá, siendo en el corto y mediano plazo, un problema de salud pública y afectando a un considerable número de personas a través del mundo a pesar de la clara relación entre exposición-desarrollo de la enfermedad y los esfuerzos en prohibir el uso del asbesto.
Los fenómenos fisiopatológicos que constituyen la EPPA aún no están del todo claros; sin embargo, existen líneas de investigación que se esfuerzan en esclarecerlos, siendo esperable que su mejor comprensión
podrá en un futuro optimizar la terapéutica y quizás la pesquisa precoz de este grupo de patologías.
Actualmente la evidencia ha demostrado que las imágenes son útiles para ser usadas como método de pesquisa precoz en poblaciones de alto riesgo, por lo que el reconocimiento de algunos hallazgos radiológicos característicos en la radiografía de tórax y en la TC se hace indispensable. La TCAR es el método de mejor rendimiento para el estudio imagenológico de EPPA.
Ante una historia de exposición a asbesto, un alto índice de sospecha en conjunto con técnicas de imagen actuales constituyen en la gran mayoría de los casos un gran acercamiento al diagnóstico definitivo de la EPPA, siendo los hallazgos imagenológicos piezas centrales en el eje diagnósticoterapéutico. La diferenciación de las diferentes entidades que constituyen la EPPA es de gran importancia, dado que influye de gran manera en una correcta planificación terapéutica. Es por esto que la correcta interpretación e identificación de los principales hallazgos radiológicos se hace fundamental, siendo clave su reconocimiento en el adecuado contexto clínico.
REFERENCIAS
1. Roggli VL, Gibbs AR, Attanoos R, Churg A, Popper H, Cagle P et al. Pathology of asbestosis-An update of the diagnostic criteria: Report of the asbestosis committee of the college of american pathologists and pulmonary pathology society. Arch Pathol Lab Med 2010;134:462-80.
2. Cugell DW, Kamp DW. Asbestos and the pleura: a review. Chest 2004;125:1103-17.
3. World Health Organization (WHO). Asbestos: Elimination of Asbestos-Related Diseases. Media Centre: WHO, 2010.
4. Contreras G, Torrealba B, Salinas M. Enfermedades respiratorias laborales en Chile: Ley 16.744. Rev Chil Enferm Respir 2014;30:27-34.
5. Peto J, Seidman H, Selikoff IJ. Mesothelioma mortality in asbestos workers: implications for models of carcinogenesis and risk assessment. Br J Cancer 1982;45:124–35.
6. Glazer CS, Newman LS. Occupational interstitial lung disease. Clin Chest Med 2004;25:467-78, vi.
7. Solari S, Goycolea M, Villarroel L, Urzúa I, Beroíza T, Ricci F. Determinación de péptidos solubles relacionados a mesotelina para la detección precoz del mesotelioma maligno. Rev Chil Enferm Respir 2012;28:182-8.
8. Liu G, Cheresh P, Kamp DW. Molecular basis of asbestos-induced lung disease. Annu Rev Pathol 2013;8:161-87.
9. Case BW, Abraham JL, Meeker G, Pooley FD, Pinkerton KE. Applying definitions of “asbestos” to environmental and “low-dose” exposure levels and health effects, particularly malignant mesothelioma. J Toxicol Environ
Health 2011;14:3–39.
10. Pinkerton KE, Young SL, Fram EK, Crapo JD. Alveolar type II cell responses to chronic inhalation of chrysotile asbestos in rats. Am J Respir Cell Mol Biol 1990; 3:543–52.
11. American Thoracic Society. Diagnosis and initial management of nonmalignant diseases related to asbestos. Am J Respir Crit Care Med 2004;170:691-715.
12. Warheit DB, Snajdr SI, Hartsky MA, Frame SR. Lung proliferative and clearance responses to inhaled para-aramid RFP in exposed hamsters and rats: comparisons with chrysotile asbestos fibers. Environ Health Perspect 1997;105:1219–22.
13. Roach HD, Davies GJ, Attanoos R, Crane M, Adams H, Phillips S. Asbestos: when the dust settles an imaging review of asbestos related disease. Radiographics 2002;22 Spec No:S167-184.
14. Huuskonen O, Kivisaari L, Zitting A, Taskinen K, Tossavainen A, Vehmas T. High-resolution computed tomography classification of lung fibrosis for patients with asbestos-related disease. Scand J Work Environ Health 2001;27:106-12.
15. Neri S, Borashi P, Antonelli A, Falaschi F, Baschieri L. Pulmonary function, smoking habits, and high resolution computed tomography (HRCT) early abnormality of lung and pleural fibrosis in shipyard workers exposed to asbestos. Am J Ind Med 1996;30:588–95.
16. Kraus T, Raithel HJ, Hering KG. Evaluation and classification of high-resolution computed tomographic findings in patients with pneumoconiosis. Int Arch Occup Environ Health 1996;68:249-54.
17. Murray CP, Wong PM, Teh J, de Klerk N, Rosenow T, Alfonso H et al. Ultra low dose CT screen-detected non-malignant incidental findings in the Western Australian Asbestos Review Programme. Respirology 2016 Jun 16.
18. Peacock C, Copley SJ, Hansell DM. Asbestosrelated benign pleural disease. Clin Radiol 2000;55:422-32.
19. Wolff H, Vehmas T, Oksa P, Rantanen J, Vainio H. Asbestos, asbestosis, and cancer, the Helsinki criteria for diagnosis and attribution 2014: recommendations. Scand J Work Environ Health 2015;41:5-15.
20. Staples CA. Computed tomography in the evaluation of benign asbestos-related disorders. Radiol Clin N Am 1992;30:1191–207.
21. Lynch DA, Gamsu G, Aberle DR. Conventional and high-resolution tomography in the diagnosis of asbestos-related diseases. RadioGraphics 1989;9:523–51.
22. Al Jarad N, Poulakis N, Pearson MC, Rubens MB, Rudd RM. Assessment of asbestosinduced pleural disease by computed tomography: correlation with chest radiograph and lung function. Respir Med 1991;85:203–8.
23. Norbet C, Joseph A, Rossi SS, Bhalla S, Gutierrez FR. Asbestos-related lung disease: a pictorial review. Curr Probl Diagn Radiol 2015;44:371-82.
24. Stathopoulos GT, Karamessini MT, Sotiriadi AE, Pastromas VG. Rounded atelectasis of the lung. Respir Med 2005;99:615-23.
25. McAdams HP, Erasums JJ, Patz EF, Goodman PC, Coleman RE. Evaluation of patients with round atelectasis using 2-(18F)-fluoro-2-deoxy-D-glucose PET. J Comput Assist Tomogr 1998;22:601-4.
26. Cvitanović S, Znaor L, Konsa T, Ivancević Z, Perić I, Erceg M et al. Malignant and nonmalignant asbestos-related pleural and lung disease: 10-Year follow-up study. Croat Med J 2003;44:618-25.
27. Aberle DR, Gamsu G, Ray CS, Feuerstein IM. Asbestos-related pleural and parenchymal fibrosis: detection with high-resolution CT. Radiology 1988;166:729–34.
28. Gamsu G, Salmon CJ, Warnock, Blanc PD. CT quantification of interstitial fibrosis in patients with asbestosis: a comparison of two methods. AJR Am J Roentgenol 1995;164:63–8.
29. Rodriguez F. Diagnóstico y tratamiento del mesotelioma pleural maligno. Arch Bronconeumol 2015;51:177-84.
30. Nickell LT Jr, Lichtenberger JP 3rd, Khorashadi L, Abbott GF, Carter BW. Multimodality imaging for characterization, classification, and staging of malignant pleural mesothelioma. Radiographics 2014;34:1692-706.
31. Metintas M, Ucgun I, Elbek O, Erginel S, Metintas S, Kolsuz M et al. Computed tomography features in malignant pleural mesothelioma and other commonly seen pleural diseases. Eur J Radiol 2002;41:1-9.
32. Tossavainen A. Asbestos, asbestosis, and cancer: the Helsinki criteria for diagnosis and attribution. Scand J Work Environ Health 1997;23:311-6.
33. Wechsler RJ, Rao VM, Steiner RM. The radiology of thoracic malignant mesothelioma. Crit Rev Diagn Imaging 1984;20:283-310.
34. Kawashima A, Libshitz HI. Malignant pleural mesothelioma: CT manifestations in 50 cases. AJR Am J Roentgenol 1990;155:965–9.
35. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359-86.
36. Wang ZJ, Reddy GP, Gotway MB, Higgins CB, Jablons DM, Ramaswamy M et al. Malignant pleural mesothelioma: evaluation with CT, MR imaging, and PET. Radiographics 2004;24:105-19.
37. Rosado-de-Christenson ML, Templeton PA, Moran CA. Bronchogenic carcinoma: radiologic-pathologic correlation. Radiographics 1994;14:429-46.
38. Kim KI, Kim CW, Lee MK, Lee KS, Park CK, Choi SJ et al. Imaging of occupational lung disease. Radiographics 2001;21:1371-91.
Correspondencia:
 José Weisz Casal
José Weisz Casal
 Estudiante Medicina, Universidad de Chile
Estudiante Medicina, Universidad de Chile
 562 2978 8412
562 2978 8412
 [email protected]
[email protected]