Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Tomosíntesis digital mamaria: puesta al día
Conventional mammography has been used for decades for breast cancer screening. Its limitations are well known and are partly related to the fact that with conventional imaging, the three-dimensional volume of the breast is imaged and presented in a two-dimensional format, which leads to low sensitivity in detecting some cancers and high false-positive recall rates. Digital breast tomosynthesis consists in the acquisition of several low dose images from slightly different angles which are then sent to a computer that uses the data to generate 3-D images, providing breast images which are virtually free from superimposition. This is in particular important in cases of high mammographic density to differentiate real masses and architectural distortions from the overlying parenchyma. Digital breast tomosynthesis has shown decreased false-positive callback rates and increased rates of cancer detection, resulting in increased sensitivity and specificity, without a significant increase in the radiation dose.
Rev Hosp Clin Univ Chile 2016; 27(1): 46-54
Alejandra López P., Ángela Castillo M., Valeria Buttinghausen G.
En Chile en el año 2013 el cáncer de mama alcanzó una tasa de mortalidad de 15,6 por 100.000 mujeres, con un total de 1.389 muertes. Según género y edad, el cáncer de mama afecta preferentemente a mujeres mayores de 15 años, constituyendo la primera causa de muerte por tumores malignos en el género femenino(1).
La mamografía convencional en dos dimensiones es el único método eficaz como estrategia de detección temprana que ha demostrado reducir el riesgo de mortalidad específica por cáncer de mama hasta en un 30%(2,3); sin embargo, sus limitaciones son conocidas y tienen relación con que el volumen en tres dimensiones de la mama es representado en un formato de dos dimensiones. Esta superposición de tejido otorga una baja sensibilidad para la detección de cáncer, ocultando sus hallazgos: una alta tasa de falsos positivos con importante número de recitaciones y un bajo valor predictivo positivo para la recomendación de biopsias(4).
La tomosíntesis digital mamaria (TDM) es una nueva tecnología de imágenes que resuelve la limitación causada por la superposición de tejido mediante la adquisición de una serie de imágenes a bajas dosis, que posteriormente se reconstruyen en un sistema computacional, permitiendo al radiólogo examinar los datos en secciones de hasta 1 mm a partir del conjunto de datos volumétricos en la estación de trabajo.
Esta técnica ha demostrado mejorar la sensibilidad y especificidad para la detección del cáncer de mama en comparación con la mamografía digital, especialmente en casos de tumores sin calcificaciones(5,6).
Si bien el concepto básico de la tomosíntesis es concebido desde aproximadamente el año 1930, es a partir de la década de los noventa que se desarrolla para imágenes mamarias, demostrando en el año 1997 la viabilidad de la tomosíntesis digital para aplicación en mama(7). Posteriormente se han desarrollado múltiples estudios, evaluando su sensibilidad, especificidad, valor predictivo positivo y negativo tanto en screening como en diagnóstico de cáncer de mama.
TÉCNICA
La TDM comparte características tanto de la mamografía convencional como de la tomografía computada.
La mama se comprime y se mantiene fija entre la paleta de compresión y el detector, en un procedimiento similar a la mamografía. El tubo de rayos X se mueve en una especie de arco, realizando una serie de adquisiciones a bajas dosis de intervalos predefinidos, cada una con un ángulo diferente (Figura 1).
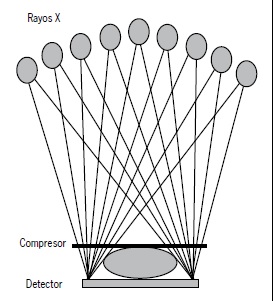
Figura 1.
Las imágenes se pueden adquirir en las proyecciones estándar (cráneo-caudal, medio-lateral-oblicua y medio-lateral). También se pueden realizar compresiones localizadas y estudios en mamas con implantes; sin embargo, no es posible realizar magnificaciones.
Posterior a la adquisición de las imágenes, éstas pueden ser reconstruidas en secciones tan delgadas como un milímetro en el plano paralelo al detector, lo que permite la estimación en tres dimensiones del tejido, ayudando a determinar de manera más exacta la ubicación de las lesiones. Dado el limitado ángulo de la adquisición, la resolución espacial es alta en el plano paralelo al detector, y levemente menor en el plano perpendicular, aún así muy por sobre la mamografía convencional y digital, lo que reduce sustancialmente los efectos de la superposición de tejido. Las imágenes son evaluadas en dos dimensiones en forma individual en la estación de trabajo.
Las imágenes que a menudo se obtienen en la evaluación clínica corresponden a una adquisición aprobada por la FDA, que combina una toma mamográfica en dos dimensiones y una adquisición de TDM durante el mismo examen. En un primer tiempo se realiza la TDM seguida de la mamografía estándar. Esta adquisición, además de permitir una mejor localización de las lesiones, permite comparar con la mama contralateral, con exámenes anteriores y la evaluación de microcalcificaciones(9).
Recientemente se ha aprobado un algoritmo de reconstrucción que sintetiza una imagen en dos dimensiones, similar a la mamografía, a partir de las múltiples adquisiciones de la tomosíntesis, lo que tendría como principal ventaja una disminución en la dosis de radiación recibida por la paciente en comparación a la combinación clásica, manteniendo los beneficios de las imágenes combinadas(10).
DOSIS DE RADIACIÓN
Una preocupación constante relacionada con la TDM corresponde al aumento de la dosis de radiación recibida por la paciente, ya que el número de imágenes que se obtienen es mayor que en la mamografía.
La medición de la dosis de radiación en la mama se reporta a través de la dosis glandular media, que distribuye la dosis en el tejido fibroglandular mamario en situación de riesgo.
Varios estudios independientes han demostrado que la dosis glandular media de la TDM es solo ligeramente mayor comparada con la mamografía convencional; sin embargo, es discutible si esto constituye un riesgo significativo asociado. Existe un significativo aumento de la radiación recibida cuando se combina la TDM más una mamografía. Una manera efectiva de disminuir la radiación es utilizando una imagen sintetizada en dos dimensiones en vez de adquirir una mamografía adicional, reduciendo en aproximadamente un 45% la dosis glandular media recibida(11-13).
UTILIDAD EN SCREENING
La TDM ha sido principalmente evaluada en población diagnóstica, existiendo aún pocos estudios que avalen su utilidad real en screening.
En este ámbito, recientemente ha sido publicado un estudio norteamericano retrospectivo que incluyó 85.552 mujeres evaluadas con mamografía o TDM entre los años 2011 y 2014, demostrando que el uso de TDM en screnning detectó un 54,3% más carcinomas que la mamografía sola (p<0.018). La tasa de recitaciones a exámenes complementarios fue de un 7,5% para mamografía y un 6,15% para TDM (p<0,0001). La tasa de recitaciones para la TDM fue menor para todas las densidades mamarias, con significativa reducción en pacientes con mamas heterogéneamente o extremadamente densas. Así mismo, fue menor en pacientes de todas las edades, pero principalmente en aquellas entre la quinta y séptima década de la vida. En conclusión, este estudio demostró que el uso de la TDM aumenta significativamente la detección del cáncer de mama y disminuye a tasa de recitaciones(14).
Otros estudios prospectivos y retrospectivos, comparando principalmente mamografía versus mamografías más TDM observaron aumento o no disminución en la tasa de detección de cáncer, aumentando el valor predictivo positivo, y disminución en la tasa de recitaciones(15-17).
UTILIDAD EN DIAGNÓSTICO
La mamografía diagnóstica se utiliza para evaluar aquellas anomalías detectadas en la mamografía de screening y para proporcionar seguimiento a corto plazo a las pacientes con hallazgos presuntamente benignos. La ultrasonografía se utiliza a menudo como complemento a la mamografía(18). Aunque este algoritmo que utiliza mamografía y ecografía complementaria ha sido útil en el diagnóstico de pacientes con cáncer de mama, el valor predictivo positivo de una interpretación mamográfica anormal alcanza sólo un 21 a 36%(19,20). La sensibilidad promedio de todas las técnicas complementarias utilizadas para el diagnóstico mamográfico se ha informado en aproximadamente un 85%(21), por lo que hay espacio para mejorar no sólo en la identificación de cánceres de mama, sino también para evitar la realización de imágenes y biopsias innecesarias.
La TDM es otra técnica, además del ultrasonido y las proyecciones mamográficas complementarias, que puede ser utilizada para diagnóstico de aquellas anomalías visualizadas en mamografía en diversos escenarios clínicos(22-25). En el ajuste diagnóstico, la TDM puede mejorar la visibilidad de una lesión, especialmente en el cáncer de mama sutil y puede mejorar el rendimiento más allá del alcanzado con la mamografía diagnóstica tradicional.
Visibilidad de una lesión
Varios estudios han demostrado una mejor visualización del cáncer de mama invasor en la TDM. Un 16% de los cánceres de mama invasores fueron ocultos en la mamografía convencional, frente al 3% en TDM, por lo que la TDM es útil en la representación de los cánceres que son sutiles u ocultos en imágenes convencionales(26). Se ha demostrado superioridad en la detección del carcinoma lobulillar invasor en la TDM comparado con la mamografía sola, ya que el patrón típico de crecimiento del tumor en filas puede no formar una masa(26).
La mayoría de los cánceres de mama son visibles en dos proyecciones (cráneo caudal y medio lateral oblicua); sin embargo, incluso en la TDM algunos tipos de cáncer son sólo visibles en una proyección.
Es por esto que actualmente se recomienda el uso de TDM en dos proyecciones para diagnóstico(27,28).
RENDIMIENTO
Múltiples estudios han demostrado mejoría en la sensibilidad, especificidad y exactitud diagnóstica de la TDM respecto a las proyecciones complementarias mamográficas diagnósticas, como las localizaciones y compresiones en la evaluación de lesiones no calcificadas. Así mismo, con respecto al uso de la ultrasonografía, la TDM disminuyó en aproximadamente un 12% el uso de esta exploración como elemento de apoyo diagnóstico(29).
Philpotts et al(30) estudiaron el flujo de trabajo antes y después de la introducción de la TDM en la práctica clínica, demostrando una disminución de un 32% en el número de imágenes adicionales obtenidas, con un 72% de pacientes que no requirieron exploraciones complementarias comparadas con una población similar un año antes de la implementación de la TDM, llevando esto a un flujo de trabajo más rápido, con un mayor rendimiento y utilización de recursos.
La selección de pacientes para la TDM en términos de densidad es un tema aún en desarrollo, evidenciándose hasta ahora que la mayor exactitud diagnóstica se obtiene en mujeres con mamas con densidades fibroglandulares dispersas y heterogéneamente densas(31).
Por último, en el entorno diagnóstico, la TDM disminuye las lesiones clasificadas como BIRADS 3, particularmente asimetrías y masas, con un aumento concomitante de lesiones BIRADS 1, 2 ó 5(31).
USOS PRÁCTICOS DE TDM
Distorsión de la arquitectura
Es importante detectar una distorsión de la arquitectura, ya que ésta tiene un alto valor predictivo positivo para cáncer de mama en aproximadamente un 60% de los casos(33).
A menudo puede ser difícil de diagnosticar en imágenes convencionales, incluyendo proyecciones complementarias, ya que puede tener una densidad similar al tejido circundante, ser visible en una sola proyección y tener áreas de tejido graso asociado.
La distorsión de la arquitectura es una manifestación común de cáncer en la TDM. Éste fue el hallazgo primario en un 12% de cánceres notados con este método. De los cánceres que se manifestaron con distorsión de la arquitectura, un 50% fueron ocultos en la mamografía convencional, y un 20% fueron caracterizados como asimetría o asimetría focal(26).
Asimetría focal
La asimetría focal se refiere a una pequeña cantidad de tejido fibroglandular visible en dos proyecciones, unilateral, sin representación en la mama contralateral.
La TDM es utilizada para confirmar y caracterizar la lesión como una asimetría verdadera, descartarla o reclasificarla como una masa. Estudios han demostrado una alta sensibilidad de la TDM (93,8%) para la visualización de la lesión y para su diferenciación entre suma de tejido y lesión verdadera versus la compresión localizada (50,2%)(34).
Masas
Las masas son caracterizadas por su forma, margen y densidad. Estos hallazgos son mejor definidos en la TDM versus la mamografía, reclasificando a menudo las lesiones respecto del examen de screening.
La frecuencia de uso del descriptor “irregular” disminuyó significativamente con la TDM, con aumento de la forma oval. Respecto a los márgenes, la TDM ha mostrado mejorar el detalle de estos, reclasificando como espiculados o indistintos aquellos que fueron obscurecidos en las compresiones localizadas.
Aquellas masas con alta densidad en mamografía tienen un alto nivel de sospecha. Aunque los márgenes y la forma de la masa es mejor definida en TDM, la densidad puede no ser tan evidente en un corte individual, por lo que la mayoría de los cánceres a menudo no se presentan como hiperdensos en la TDM comparada con la mamografía(29).
Recientemente ha sido evaluada la presencia de tejido graso encontrado en las masas, lo que en mamografía habitualmente se asocia a benignidad. En TDM, el tejido graso es habitualmente encontrado en las lesiones, incluso en las neoplásicas, lo que puede falsamente disminuir la sospecha de malignidad. La presencia de grasa no debe frenar la biopsia si la forma y márgenes son sospechosos. En estos casos es importante categorizar la lesión según el descriptor más sospechoso(36).
Localización de hallazgos visualizados en una sola proyección
Una asimetría focal es considerada sospechosa si es nueva, más densa, asociada a microcalcificaciones o de mayor tamaño. En la evaluación es de vital importancia visualizar la lesión en dos proyecciones. Existen diferentes alternativas en mamografía para poder localizar una lesión que es visualizada en una sola proyección, como la triangulación, compresión o rolled. En TDM, como se adquieren múltiples imágenes en una especie de arco, la posición de las lesiones es obtenida en forma inmediata(29).
Estadiaje del cáncer de mama
Después de identificar una lesión como sospechosa de cáncer, se debe evaluar su tamaño y una posible ultifocalidad, multicentricidad o enfermedad contralateral.
Determinar mamográficamente el tamaño de una lesión puede ser difícil. En TDM se puede medir el núcleo de la masa y no incluir espículas que pueden ser vistas en imágenes individuales. Muchos estudios han demostrado que las mediciones obtenidas en TDM se correlacionan en buena medida con las medidas anatomopatológicas en lesiones mayores a 20 mm, siendo superior a la mamografía, aún en mujeres con mamas densas(37,38).
La presencia de multifocalidad o multicentricidad puede afectar de manera importante la elección del tratamiento, conservador versus mastectomía total. La TDM puede representar lesiones satélites y visualizarlas con gran detalle(29).
Hasta un 2 a 3% de las mujeres con diagnóstico de cáncer de mama tienen lesiones malignas en la mama contralateral. La TDM ha demostrado ser útil en la evaluación de la mama contralateral cuando la resonancia magnética no se puede utilizar de rutina(29).
LIMITACIONES
Potenciales falsos negativos de la técnica pueden encontrarse en mamas extremadamente densas, en donde los hallazgos pueden ser obscurecidos por el parénquima. Los cánceres pueden ser ocultos incluso en la TDM.
La TDM provee una variable visualización de microcalcificaciones(39), por lo que se hace necesaria la magnificación para su caracterización, siendo esta una de las principales limitaciones de la técnica.
CONCLUSIÓN
La TDM ha demostrado, tanto en screening como en imágenes de complemento diagnóstico, tener una mejor sensibilidad y especificidad para la detección de lesiones neoplásicas, disminuyendo los falsos positivos y falsos negativos respecto a la mamografía digital y convencional.
Existe una importante reducción en la tasa de recitaciones, lo que se ve reflejado en un flujo de trabajo más expedito. Este beneficio se obtiene a cambio de un aumento no significativo en la dosis de radiación obtenida por la paciente.
Algunos factores a tener en cuenta son el costo y la disponibilidad de la técnica, al igual que la necesidad de almacenamiento de las imágenes y capacitación de los radiólogos.
La TDM se perfila como la técnica de elección en imágenes mamarias, con una mejor utilización de los recursos sanitarios.
REFERENCIAS
1. Principales causas de muerte (tasas) según sexo. Chile 1997-2013. Departamento de estadísticas e información de salud. Ministerio de Salud.
2. Lehtimäki T, Lundin M, Linder N, Sihto H, Holli K, Turpeenniemi-Huajanen T et al. Long-term prognosis of breast cancer detected by mammography screening or other methods. Breast Cancer Res 2011;13:R134.
3. Tabár L, Vitak B, Chen TH, Ming-Fang A, Cohen A, Tibor T et al. Swedish Two- County Trial: impact of mammographic screening on breast cancer mortality during 3 decades. Radiology 2011;260:658–63.
4. Gartner R, Maidment A, Weinstein S, Orel S, Conant E. Digital Breast Tomosynthesis: Lessons Learned from Early Clinical Implementation. Radiographics 2014;34: 89-102.
5. Lei J, Yang P, Zhang L, Wang Y, Yang K. Diagnostic accuracy of digital breast tomosynthesis versus digital mammography for benign and malignant lesions in breasts: a meta analysis. Eur Radiol 2014; 24:595–602.
6. Andersson I, Ikeda DM, Zackrisson S, Ruschin M, Svahn T, Timberg P et al. Breast tomosynthesis and digital mammography: a comparison of breast cancer visibility and BIRADS classification in a population of cancers with subtle mammographic findings. Eur Radiol 2008;18:2817–25.
7. Niklason L, Christian B, Niklason L, Kopans D, Castleberry D, Opsahl-Ong B et al. Digital tomosynthesis in breast imaging. Radiology 1997;205:399–406.
8. Acciavatti R, Maidment A. Observation of super-resolution in digital breast tomosynthesis. Med Phys 2012;39:7518–39.
9. United States Food and Drug Adminstration. MQSA facil- ity certification extension requirements for digital breast tomosynthesis (DBT) system. http://www.fda.gov/Radiation-EmittingProducts/MammographyQualityStandardsActandProgram/FacilityCertificationandInspection/
ucm243765.htm. Updated May 30, 2013. Accessed March 1, 2014.
10. Skaane P, Bandos AI, Eben E, Jebsen I, Krager M, Haakennaasen et al. Two-view digital breast tomosynthesis screening with synthetically reconstructed projection images: comparison with digital breast tomosynthesis with full-field digital mammographic images. Radiology 2014;271:655–63.
11. Hendrick R, Pisano E, Averbukh A, Moran C, Berns E, Yaffe M et al. Comparison of acquisition parameters and breast dose in digital mammography and screen-film mammography in the American College of Radiology Imaging Network digital mammographic imaging screening trial. AJR Am J Roentgenol 2010;194:362–9.
12. Hendrick R. Radiation doses and cancer risks from breast imaging studies. Radiology 2010;257:246–53.
13. Svahn T, Houssami N, Sechopoulos I, Mattsson S. Review of radiation dose estimates in digital breast tomosynthesis relative to those in two-view full-field digital mammography. Breast 2015;24:93–9.
14. Sharpe E, Venkataraman Sh, Phillips J, Dialani V, Fein-Zachary V, Prakash S et al. Increased cáncer detection rate and variations in the recall rate resulting from implementation of 3D digital breast tomosynthesis into a population-based screening program. Radiology 2016;278:698-706.
15. Ciatto S, Houssami N, Bernardi D, Caumo F, Pellegrini M, Brunelli S et al. Integration of 3D digital mammography with tomosynthesis for population breast-cancer screening (STORM): a prospective comparison study. Lancet Oncol 2013;14:583–9.
16. Skaane P, Bandos A, Gullien R, Eben E, Ekseth U, Haakenaasen U et al. Prospective trial comparing full-field digital mammography (FFDM) versus combined FFDM and tomosynthesis in a population- based screening programme using independent double reading with arbitration. Eur Radiol 2013;23:2061–71.
17. Vedantham S, Karellas A, Vijayaraghavan G, Kopans D. Digital Breast Tomosynthesis: State of the art. Radiology 2015; 277:663-84.
18. American College of Radiology. ACR practice guideline for the performance of screening and diagnostic mammography. http://www.acr.
org/Quality-Safety/Standards-Guidelines/Practice-Guidelines-by-Modality/Breast-Imaging. Updated 2013. Accessed March 1, 2014.
19. Sickles E, Miglioretti D, Ballard-Barbash R, Geller B, Leung J, Rosenmrg R et al. Performance benchmarks for diagnostic mammography. Radiology 2005;235:775–90.
20. Sickles E, Wolverton D, Dee K. Performance parameters for screening and diagnostic mammography: specialist and general radiologists. Radiology 2002;224:861–9.
21. National Cancer Institute. Breast Cancer Surveillance Consortium performanc benchmarks. http://breastscreening.cancer.gov/data/benchmarks/diagnostic/2009/tableSens
Spec.html. Consultado el 1 marzo 2014.
22. Poplack S, Tosteson T, Kogel C, Nagy H. Digital breast tomosynthesis: initial experience in 98 women with abnormal digital screening mammography. AJR Am J Roent Genol 2007;189:616–23.
23. Brandt K, Craig D, Hoskins T, Henrichsen T, Bendel E, Brandt S et al. Can digital breast tomosynthesis replace conventional diagnostic mammography views for screening recalls without calcifications? A comparison study in a simulated clinical setting. AJR Am J Roentgenol 2013;200:291–8.
24. Hakim C, Chough D, Ganott M, Sumkin J, Zuley M, Gur D. Digital breast tomosynthesis in the diagnostic environment: a subjective side-by-side review. AJR Am J Roentgenol 2010;195:W172–W176.
25. Waldherr C, Cerny P, Altermatt H, Berclaz G, Ciriolo M, Buser K et al. Value of one-view breast tomosynthesis versus two-view mammography in diagnostic workup of women with clinical signs and symptoms and in women recalled from screening. AJR Am J Roentgenol 2013;200:226–31.
26. Dang P, Humphrey K, Freer P, Halpern E, Saksena M, Rafferty E. Comparison of lesion detection and characterization in invasive cancers using breast tomosynthesis versus conventional mammography [abstr]. In: Radiological Society of North America Scientific Assembly and Annual Meeting Program. Oak Brook, Ill: Radiological Society of North America, 2013:156.
27. Beck N, Butler R, Durand M. One-view versus two-view tomosynthesis: a comparison of breast cancer visibility in the mediolateral oblique and craniocaudal views. Presented at the annual meeting of the American Roentgen Ray Society, Washington, DC, April 14–19, 2013.
28. Baker JA Lo J. Breast tomosynthesis: stateof-the-art and review of the literature. Acad Radiol 2011;18:1298–310.
29. Peppard H, Nicholson B, Rochman C, Merchant J, Mayo R, Harvey J. Digital breast tomosynthesis in the diagnosyic setting: indications and clinical applications. Radiographics 2015;35:975-90.
30. Philpotts L, Kalra V, Crenshaw J, Butler R. How tomosynthesis optimizes patient workup, throughput, and resource utilization [abstr]. In: Radiological Society of North America Scientific Assembly and Annual Meeting Program. Oak Brook, Ill: Radiological Society of North America, 2013; 191.
32. Skaane P, Bandos A, Gullien R, Eben E, Ekseth U, Haakenaasen U et al. Comparison of digital mammography alone and digital mammography plus tomosynthesis in a population based screening program. Radiology
2013;267:47–56.
33. Raghu M, Hooley RJ, Philpotts L. Digital breast tomosynthesis in diagnostic mammography: can tomo affect the final assessment categories? [abstr]. In: Radiological Society of North America Scientific Assembly and Annual Meeting Program. Oak Brook, Ill: Radiological Society of North America, 2013;156.
34. Harvey J, March D. Making the diagnosis: a practical guide to breast imaging. Philadelphia, Pa: Elsevier Saunders, 2013.
35. ElMaadawy M, Seely J, Doherty G, Lad S. Digital breast tomosynthesis in the evaluation of focal mammographic asymmetry: do you still need coned compression views? [abstr]. In: Radiological Society of North America Scientific Assembly and Annual Meeting Program. Oak Brook, Ill: Radiological Society of North America, 2012; 158.
36. Freer P, Wang J, Rafferty EA. Digital breast tomosynthesis in the analysis of fat-containing lesions. RadioGraphics 2014;34:343–58.
37. Förnvik D, Zackrisson S, Ljungberg O, Svahn T, Timberg P, Tingberg A et al. Breast tomosynthesis: accuracy of tumor measurement compared with digital mammography and ultrasonography. Acta Radiol 2010;51:240–7.
38. Mun HS, Kim HH, Shin HJ, et al. Assessment of extent of breast cancer: comparison between digital breast tomosynthesis and full-field digital mammography. Clin Radiol 2013;68:1254–9.
39. Destounis S, Arieno A, Morgan R. Preliminary clinical experience with digital breast tomosynthesis in the visualization of breast microcalcifications. J Clin Imaging Sci 2013;3:65.
Correspondencia:
 Dra. Ángela Castillo Martínez
Dra. Ángela Castillo Martínez
 Centro Imagenología
Centro Imagenología
 [email protected]
[email protected]
 569 9733 4204
569 9733 4204