Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Marcadores de recambio óseo en mujeres postmenopáusicas: utilidad clínica
Bone metabolism is a dynamic process, which includes formation and resorption. Osteoblast and osteoclast are responsible of replacing 20% of bone each year. Bone Markers are fragments of bone matrix; these peptides are released in the process of formation and resorption, later accumulated in body compartments (bone and blood) and finally excreted in the urine, reflecting bone dynamic. The international Federation of Osteoporosis and the International Federation of Laboratory and Clinical Chemistry recommend the use of these two markers (one representing bone formation and the other bone resorption) to evaluate bone turnover, especially in high-risk groups such as postmenopausal women. The collagen C-terminal telopeptide or carboxi-terminal collagen crosslinking (CTX) is one of the most used, among different bone markers. This is a blood biomarker that can be measured to assess bone turnover; this marker increases when the bone resorption is accelerated. On the other hand, osteocalcin (a non-collagen protein) is a bone formation marker, which has been widely studied and can be measured in venous blood during bone formation. Both markers are important for monitoring anti-resorptive therapy, and they have been validated to predict fracture risk complementing densitometry in osteoporosis diagnosis. Main disadvantages are variability of the laboratory techniques and lack of information about normal reference values in different populations. Therefore it is necessary to establish normal reference values for each population before its incorporation as a clinical tool.
Rev Hosp Clin Univ Chile 2016; 27(1): 55-63
Marcela Barberán M., Patricia Díaz G., Claudio Liberman G., Maritza Garrido P.
EL CICLO DE REMODELACIÓN ÓSEA
El hueso es metabólicamente activo y constantemente está siendo reparado y remodelado durante toda la vida de un individuo. Aproximadamente el 20% del tejido óseo es reemplazado cada año. El ciclo de remodelación comienza antes del nacimiento y continúa hasta la muerte. En condiciones normales, las dos fases de este ciclo, la formación y resorción ósea están estrechamente acopladas a través de una variedad de señales reguladoras y los cambios que se producen en ambos procesos son paralelos(1).
La matriz ósea está formada por varios componentes, que en orden decreciente son: una fase mineral de hidroxiapatita, una fase orgánica de aproximadamente un 90% colágeno tipo I, 5% de proteínas no-colágenas, 2% de lípidos y agua(2). Además, el hueso está compuesto de 4 tipos celulares: osteoblastos, células de linaje óseo, osteocitos y osteoclastos(3). A pesar de su apariencia inerte, el hueso es un órgano dinámico que está bajo constante resorción por los osteoclastos y formación por los osteoblastos(3,4).
El ciclo de remodelado óseo dura entre 150 a 200 días y está mediado principalmente por señales de células osteoblásticas que promueven la diferenciación y maduración de los precursores osteoclásticos. Los osteoclastos activados crean sitios de “resorción” para disolver la matriz ósea con enzimas lisosómicas, digieren eficazmente el colágeno tipo 1 expuesto, liberando productos de degradación específicos. Los osteoblastos son atraídos a esta superficie erosionada y empieza la “formación” de nuevo tejido óseo(5). El colágeno tipo 1, abundante en osteoblastos, es secretado como un precursor pro colágeno donde se escinde en el extremo amino y carboxi-terminales, liberando propéptidos en la sangre. Inicialmente los cristales de hidroxiapatita son depositados en el hueso, un proceso de mineralización más lenta que continúa durante varios meses, seguido de un período de inactividad(1) (Figura 1).
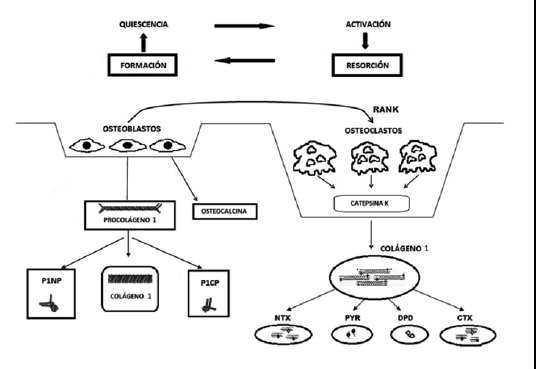
Figura 1. Ilustración de los procesos de formación y resorción ósea a cargo de los osteoblastos y osteoclastos respectivamente. Tanto en la formación de hueso como en la degradación se liberan fragmentos de proteínas como el colágeno (CTX) u osteocalcina, los que pueden ser medidos en fluidos como la sangre del paciente. (Editado de Wheater et al. J Transl Med 2013).
Los marcadores de recambio óseo (MO) son componentes de la matriz ósea medidos por lo general en sangre o en orina. Reflejan la actividad metabólica del hueso, es decir, el aumento o disminución del recambio óseo, pero sin ninguna función en controlar el metabolismo esquelético(6). Éstos expresan la actividad de todo el esqueleto independiente de la etiología, por lo que es esencial una interpretación adecuada de sus niveles.
Los MO son tradicionalmente categorizados como marcadores de formación o resorción ósea. Los marcadores de formación ósea son producidos por osteoblastos activos expresados durante las diversas fases de su desarrollo o enzimas osteoblásticas. La mayoría de los marcadores de formación ampliamente utilizados incluyen: fosfatasa alcalina específica del hueso (BSAP), osteocalcina y los propéptidos carboxi y amino-terminal del colágeno tipo 1 (P1CP, P1NP). Los marcadores de resorción ósea son productos de la degradación del colágeno y los actualmente disponibles se han convertido en los preferidos para medir la resorción. Éstos incluyen el telopétido carboxi y amino-terminal del colágeno tipo 1 (CTX y NTX respectivamente), de los cuales CTX se considera el marcador de elección(1,7).
MARCADORES ÓSEOS
La Federación Internacional de Osteoporosis (IOF) y de Química Clínica y Laboratorio (IFCC) recomiendan que un marcador de formación ósea, en este caso P1NP (procolágeno tipo 1 N propéptido) y un marcador de resorción como el CTX (telopéptido C-terminal del colágeno tipo 1), sean usados como marcadores de recambio óseo de referencia en estudios clínicos, para una adecuada estandarización de las técnicas utilizadas(6).
Dado que no contamos en nuestro país con la medición de P1NP como MO de formación, nos referiremos en esta revisión a los MO más utilizados y estudiados en la literatura internacional, que además son factibles de implementar en Chile. Estos son NMID-osteocalcina como MO de formación y CTX como marcador de resorción.
NMID-osteocalcina
La osteocalcina es la proteína no colágena más importante de la matriz ósea. Se produce por los osteoblastos durante la formación ósea y se une a la hidroxiapatita del hueso, siendo de ayuda en la mineralización(8). Posee 49 aminoácidos y ha sido ampliamente estudiada como marcador de formación ósea. Una vez en la sangre, la osteocalcina es hidrolizada rápidamente en el hígado y el riñón, dando origen a fragmentos más cortos de la sección media y los extremos N-terminal (o N-MID) y C-terminal (MID-C) los que aparentemente son mucho más estables que la osteocalcina intacta (Figura 2).

Figura 2. Esquema de la proteína no-colágena osteocalcina. Esta consta de 49 aminoácidos y es cortada en el proceso de formación de hueso, originando diferentes fragmentos. (Editado de Lee et al. Ann Clin Biochem 2000).
La principal desventaja de la medición de osteocalcina en sangre radica en que como es degradada rápidamente a los fragmentos más pequeños y éstos no son detectados por los equipos de Laboratorio en la misma cantidad y proporción, los valores de esta proteína tienen una gran variabilidad, principalmente dependiente de la técnica y tiempo que transcurre desde la toma de muestra hasta su almacenamiento y/o procesamiento(9).
Afortunadamente, para evitar el inconveniente de la variabilidad en las mediciones de osteocalcina, se desarrolló un test automatizado para cuantificar el fragmento N-MID en vez de la osteocalcina intacta, lo que disminuye enormemente las diferencias provocadas por la toma de muestra y tiempo de procesamiento y, por lo tanto, promete ser un mejor MO de formación. Además, con la finalidad de disminuir los coeficientes de variación de los resultados, los ensayos se han automatizado.
NMID-osteocalcina puede ser medida en una muestra de sangre; dependiendo la técnica a usar puede ser recolectada en tubo estándar de suero o plasma tratado con heparina o EDTA. La muestra no debe congelarse más de una vez y puede ser almacenada hasta por 3 meses a -20°C. No se deben utilizar muestras sometidas a altas temperaturas ni hemolizadas(10,11).
TELEPÉPTIDOS β CARBOXI-TERMNAL (CTX)
Cerca del 90% de la matriz ósea orgánica está constituida por colágeno tipo 1, el cual es fabricado localmente en el hueso(5,12). Durante la resorción ósea el colágeno maduro es degradado y en este proceso se desprenden pequeños fragmentos, los que son liberados y circulan en la sangre para ser eliminados por vía renal. La liberación de estos fragmentos es proporcional a la resorción ósea o bien la actividad osteoclástica tanto en condiciones fisiológicas como la vejez o bien patológicas donde la resorción se encuentra aumentada (osteoporosis)(13).
Existen varios fragmentos que pueden medirse en sangre y orina, los que se liberan tanto en la formación de la matriz ósea como en la degradación (Figura 3). Los telopéptidos β carboxi-terminal, β-cross laps o CTX son liberados durante la degradación del colágeno maduro, es decir, durante la degradación de la matriz ósea y no en su formación(14).
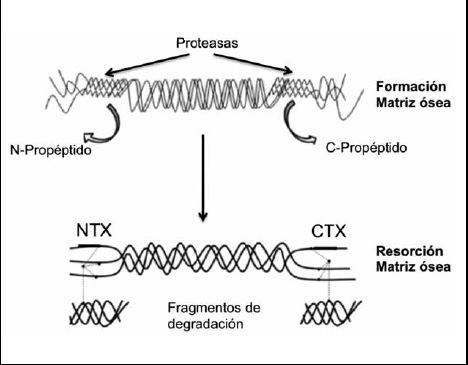
Figura 3. Esquema de la degradación del colágeno en la matriz ósea y los fragmentos liberados en este proceso, los que son cuantificados en sangre u orina reflejando la dinámica ósea. (Editado de Vasikaran et al. Clin Biochem Rev 2014).
CTX puede ser medido en una muestra de orina o sangre, siendo esta última más cómoda y práctica. Dependiendo la técnica a usar, la muestra puede ser recolectada en tubo estándar con anticoagulante EDTA o heparina sódica. Se recomienda extraer las muestras de sangre por la mañana y en ayunas. Además, es importante extraer las muestras bajo las mismas condiciones que la primera, ya que los CTX están sujetos en cierta medida a un ritmo circadiano. La muestra no debe congelarse más de una vez y puede ser almacenada hasta por 3 meses a -20°C. La hemólisis puede interferir en la medición de CTX, subestimando los valores(15).
Para obtener mediciones fiables de los marcadores antes mencionados, se deben tener en cuenta factores como edad, sexo, dieta, estacionalidad, ciclo menstrual, hábitos (ejercicio, tabaquismo), niveles adecuados de vitamina D, uso de fármacos y enfermedades asociadas. Estos factores se deben tener en cuenta para una adecuada toma de muestras e interpretación de los resultados de los MO.
UTILIDAD CLÍNICA DE MO
Bajo condiciones normales, la formación y resorción ósea están estrechamente acopladas, pero en patologías como la osteoporosis, se produce una alta tasa de resorción ósea, resultando en una disminución de la masa ósea y deterioro de su microarquitectura, lo que aumenta el riesgo de fracturas con alta morbimortalidad(1). La prevalencia de osteoporosis aumenta con la edad, siendo la pérdida ósea más acelerada en las mujeres que los hombres, sobre todo en los primeros años posterior a la menopausia por la deficiencia estrogénica.
Por este motivo las mujeres postmenopáusicas (MPM) constituyen el grupo de alto riesgo(16). La OMS ha definido osteoporosis mediante el examen de densitometría ósea o DMO (que es el gold standard) cuyo resultado debe ser menor a 2.5 desviaciones estándar del peak de masa ósea media de mujeres premenopáusicas. A pesar de que la DMO tiene alta especificidad, su sensibilidad no es óptima y los cambios suelen ser evidentes entre 1-2 años, por lo que puede desestimar el potencial alto riesgo de fracturas al ser usado sin otros parámetros, como por ejemplo, los MO que pueden complementar los resultados de la DMO en el manejo de la osteoporosis. Se han desarrollado técnicas de medición de MO confiables, rápidas, no invasivas y costo-efectivas para mejorar la sensibilidad y especificidad de la DMO, aunque aún existe variabilidad entre éstas(10).
La edad, el sexo y la menopausia generan variabilidad en los MO(17), siendo elevados en las MPM por un aumento del recambio en comparación a los hombres. En mujeres sanas, por ejemplo, la osteocalcina y CTX disminuyen con el incremento de la edad hasta los 44 años, para luego presentar un incremento entre los 50 y 59 años(18). Las mujeres tienen pérdidas óseas lentas de 1 a 2% por año después de la menopausia. El aumento de los niveles de los MO en las MPM está asociado a pérdidas óseas aceleradas en diferentes sitios óseos estudiados, lo que ocurre en 30% de las MPM.
La principal utilidad de los MO es la monitorización del tratamiento anti-resortivo(19). Varios trabajos internacionales han documentado una disminución de MO de resorción en días o semanas (por ejemplo, CTX disminuye entre un 50-70% a las 12 semanas) y de MO de formación posterior al inicio del tratamiento antiresortivo, y la no disminución sería indicativo de poca adherencia a la terapia o ausencia de respuesta a ésta. Dichos cambios se pueden evidenciar mucho más rápido que a través de la DMO, con la que habría que esperar varios meses(18).
Estudios poblacionales han mostrado que los MO son útiles en la predicción de fracturas independiente de la DMO en MPM sanas, pero a pesar de la potencial utilidad de los MO en el riesgo de fracturas y su manejo, el uso ha sido dificultado por su variabilidad población y técnica dependiente. Nuestro país no cuenta con rangos referenciales de MO, por lo que es necesario estudiar su comportamiento en nuestra población chilena de MPM.
MARCADORES ÓSEOS EN MUJERES POSTMENOPÁUSICAS
Existen estudios internacionales que han evaluado los rangos referenciales de osteocalcina, NMIDosteocalcina y CTX a diferentes edades, pero en varios de éstos no se caracterizó el estatus óseo de los voluntarios. Además, los marcadores óseos varían según varios factores previamente mencionados, por lo que a pesar que estos valores pueden darnos una idea de los que podríamos encontrar en nuestra población, no necesariamente deberán ser comparables. De hecho la literatura aconseja que cada laboratorio tenga sus rangos de referencia propios, de acuerdo a su población y técnica(10).
La mejor evidencia de la literatura acerca de los niveles de MO en este grupo de MPM, es un metaanálisis (MA) realizado en el año 2012 que estudió la utilidad de varios MO para predecir osteoporosis en mujeres y hombres de todas las edades. Los niveles en plasma de MO resultaron ser más elevados en las MPM con DMO en columna y cadera más disminuida, no así en el grupo de mujeres premenopáusicas, incluyendo MO como osteocalcina y CTX. Además en este estudio se encontró que los niveles de CTX y fosfatasas alcalinas óseas eran más elevados en aquellas mujeres que tenían steoporosis en comparación a mujeres controles sin esta patología(20).
Por otra parte, el primer MA publicado recientemente (en el año 2014) que estudió la asociación entre el riesgo de fracturas y los niveles de MO en MPM y hombres mayores, específicamente CTX y P1NP, encontró una modesta asociación entre niveles elevados de estos MO con un aumento del 20% en el riesgo relativo de fracturas en cualquier localización(21).
Se pueden encontrar escasos estudios observacionales que intentan establecer los rangos de referencia para osteocalcina y CTX en el grupo de mayor riesgo como son las mujeres postmenopáusicas, realizados en países europeos y asiáticos. Algunos de ellos intentan establecer valores para discriminar el estatus óseo normal y patológico, ajustando por diferentes variables confundentes como DMO, edad, edad de la menopausia y otros como IMC o niveles de Vitamina D. La mayoría utiliza técnicas automatizadas de electro quimioluminiscencia (ECLIA) y con mediciones en plasma. Estos estudios han reportados niveles promedios de osteocalcina en plasma en MPM controles de 12- 24 ng/ml y en MPM con osteoporosis de 6,0 a 27,2 ng/ml. En los estudios que evaluaron CTX se encontró niveles promedio en plasma en MPM controles de 0,33 a 0,45 ng/ml y en MPM con osteoporosis de 0,43 a 0,53 ng/ml significativamente más elevados respecto a controles (Tabla 1 y 2).
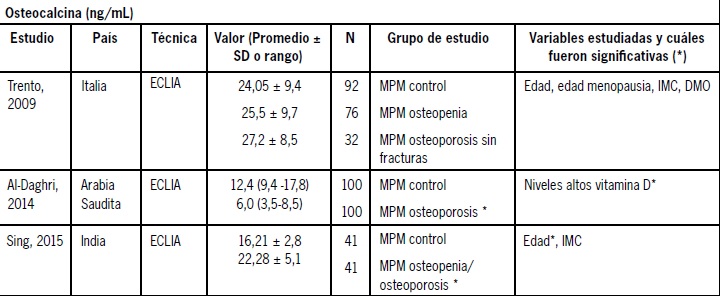
Tabla 1. Estudios relacionados a osteocalcina en mujeres post menopáusicas recopilados en la literatura internacional.
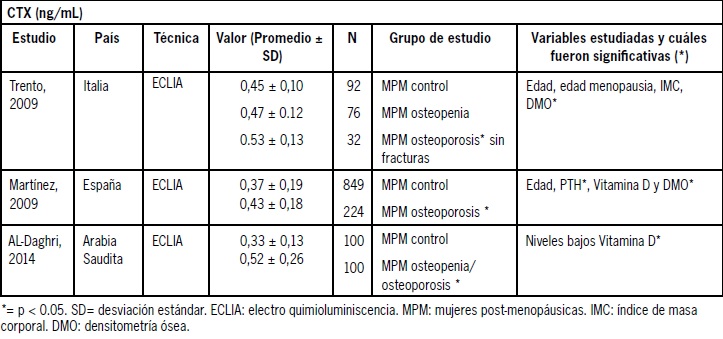
Tabla 2. Estudios relacionados a CT X en mujeres post menopáusicas recopilados en la literatura internacional.
CONCLUSIONES
Los MO son de utilidad en el monitoreo del tratamiento anti resortivo y como una herramienta para predecir riesgo de fractura complementario a la DMO.
Es aconsejable la medición de MO bajo las condiciones de mayor similitud posible y evaluar las diferencias existentes en cada población de estudio.
De esto se infiere la importancia de establecer valores normales para estos MO sujetos a las características de nuestra población.
En Chile no existen datos al respecto, por lo que se decidió determinar los valores referenciales de un marcador de resorción (CTX) y otro de formación (NMID-osteocalcina) en MPM sanas, como población de riesgo, y MPM con osteopenia u osteoporosis. Esto nos permitirá caracterizar de mejor manera nuestra población y establecer los requisitos para la utilización de los MO en el ámbito clínico.
REFERENCIAS
1. Wheater G, Elshahaly M, Tuck SP, Datta HK, van Laar JM. The clinical utility of bone marker measurements in osteoporosis. J Transl Med 2013;11:201.
2. Boskey AL. Bone composition: relationship to bone fragility and antiosteoporotic drug effects. Bonekey Rep 2013;2:447.
3. Florencio-Silva R, Sasso GR, Sasso-Cerri E, Simoes MJ, Cerri PS. Biology of bone tissue: structure, function, and factors that influence bone cells. Biomed Res Int 2015;421746.
4. Clarke, B. Normal bone anatomy and physiology. Clin J Am Soc Nephrol 2008;3 Suppl 3,S131-139.
5. Martin T, Gooi JH, Sims NA. Molecular mechanisms in coupling of bone formation to resorption. Crit Rev Eukaryot Gene Expr 2009;19:73-88.
6. Vasikaran S, Eastell R, Bruyère O, Foldes AJ, Garnero P, Griesmacher A et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int 2011;22:391-420.
7. Sandhu SK, Hampson G. The pathogenesis, diagnosis, investigation and management of osteoporosis. J Clin Pathol 2011;64:1042-50.
8. Hlaing TT, Compston JE. Biochemical markers of bone turnover - uses and limitations. Ann Clin Biochem 2014;51:189-202.
9. Ivaska KK, Hentunen TA, Vääräniemi J, Ylipahkala H, Pettersson K, Väänänen HK. Release of intact and fragmented osteocalcin molecules from bone matrix during bone resorption in vitro. J Biol Chem 2004;279:18361-9.
10. Lee J, Vasikaran S. Current recommendations for laboratory testing and use of bone turnover markers in management of osteoporosis. Ann Lab Med 2012;32:105-12.
11. Lombardi G, Lanteri P, Colombini A, Banfi G. Blood biochemical markers of bone turnover: pre-analytical and technical aspects of sample collection and handling. Clin Chem Lab Med 2012;50:771-89.
12. Sims NA, Martin TJ. Coupling the activities of bone formation and resorption: a multitude of signals within the basic multicellular unit. Bonekey 2014; Rep 3:481.
13. Pagani F, Francucci CM, Moro L. Markers of bone turnover: biochemical and clinical perspectives. J Endocrinol Invest 2005;28:8-13.
14. Garnero P, Mulleman D, Munoz F, Sornay-Rendu E, Delmas PD. Long-term variability of markers of bone turnover in postmenopausal women and implications for their clinical use: the OFELY study. J Bone Miner Res 2003;18:1789-94.
15. Vasikaran SD, Chubb SP, Ebeling PR, Jenkins N, Jones GR, Kotowicz MA et al. Harmonised Australian reference intervals for serum PINP and CTX in adults. Clin Biochem Rev 2014;35:237-42.
16. Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S et al. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int 2014;25:2359-81.
17. Albrand G, Munoz F, Sornay-Rendu E, DuBoeuf F, Delmas PD. Independent predictors of all osteoporosis-related fractures in healthy postmenopausal women: the OFELY study. Bone 2003;32:78-85.
18. Hu WW, Zhang Z, He JW, Fu WZ, Wang C, Zhang H et al. Establishing reference intervals for bone turnover markers in the healthy shanghai population and the relationship with bone mineral density in postmenopausal women. Int J Endocrinol 2013;513925.
19. Tankó LB, Mouritzen U, Lehmann HJ, Warming L, Moelgaard A, Christgau S et al. Oral ibandronate: changes in markers of bone turnover during adequately dosed continuous and weekly therapy and during different suboptimally dosed treatment regimens. Bone 2003;32:687-93.
20. Biver E. Use of bone turnover markers in clinical practice. Curr Opin Endocrinol Diabetes Obes 2012;19:468-73.
21. Johansson H, Odén A, Kanis JA, McCloskey EV, Morris HA, Cooper C et al. A metaanalysis of reference markers of bone turnover for prediction of fracture. Calcif Tissue Int 2014;94:560-7.
Correspondencia:
 Dra. Marcela Barberán Manríquez
Dra. Marcela Barberán Manríquez
 Sección de Endocrinología, Departamento de Medicina
Sección de Endocrinología, Departamento de Medicina
 [email protected]
[email protected]
 562 2978 8460 / 562 2978 8430
562 2978 8460 / 562 2978 8430