Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Fármacos de repropósito para combatir la quimiorresistencia en el cáncer ovárico epitelial
Epithelial ovarian cancer (EOC) is one of the most lethal gynecological cancers both in Chile and worldwide. Treatment in advanced stages is cytoreductive surgery followed by chemotherapy, based on platinum and taxanes. Unfortunately, resistance to chemotherapy is a frequent phenomenon in patients with EOC, worsening their prognosis. Therefore, the study of new drugs or complementary therapies to existing ones is essential to benefit EOC patients. Drug repurposing, or the use of old drugs that are commonly used for other purposes, may be key in the development of new therapies for EOC. This strategy, unlike de novo drug development, can be much cheaper, safer, and faster to implement. In this context, widely used drugs such as metformin and nonsteroidal anti-inflammatory drugs (NSAIDs) have shown promising antitumor effects in the context of cancer, including in different EOC models. In this work, we review the current evidence related to the antitumor effects of metformin and NSAIDs in tumor cells, with an emphasis on ovarian cancer cells and their projections for use in the context of EOC.
Rev Hosp Clín Univ Chile 2023; 34: 214 - 26. doi: 10.5354/2735-7996.2023.72916
Maritza P. Garrido P., Carmen Romero O
El cáncer ovárico ocupa el quinto lugar de mortalidad por cáncer femenino y constituye la primera causa de mortalidad entre los cánceres ginecológicos en países desarrollados(1,2). Más del 95% de los cánceres ováricos son de origen epitelial (COE) y se caracterizan por su sintomatología inespecífica y diagnóstico tardío, lo que se traduce en que las pacientes tienen tasas de supervivencia bajas. En Chile el COE es la segunda causa de muerte por cáncer de origen ginecológico y su tratamiento se encuentra garantizado por la ley GES, pero a pesar de esto, su mortalidad sigue siendo alta, ya que en estadios avanzados su tasa de supervivencia a 5 años es menor a 35%(3,4).
El cáncer ovárico es diagnosticado contra biopsia, pero se sospecha mediante ultrasonografía transvaginal, considerando la morfología y características de la lesión, junto con la aplicación de modelos ecográficos de riesgo, como, por ejemplo, el sistema IOTA (The International Ovarian Tumor Analysis Group). Este es un conceso de expertos, el cual ha desarrollado y validado modelos predictivos basados en series de datos multicéntricos con definiciones y recolección de datos estandarizados(5). Además el diagnóstico se apoya en la medición de marcadores séricos clásicos como el CA-125(6) o nuevos marcadores emergentes como la proteína epididimal humana 4 (HE-4)(7), los que son producidos en elevadas cantidades por las neoplasias ováricas; sin embargo, el diagnóstico definitivo lo da la Anatomía Patológica de la pieza operatoria.
De acuerdo a la guía del Ministerio de Salud de Chile, el tratamiento recomendado para el cáncer ovárico es la cirugía citorreductiva seguida de quimioterapia adyuvante de primera línea: cisplatino o carbaplatino más paclitaxel (3-6 ciclos)(8). Ambos son fármacos que inhiben la replicación celular, induciendo la muerte de las células en proceso proliferativo(9,10). De forma complementaria, en etapas avanzadas del COE, también se pueden utilizar compuestos biológicos inhibidores de la angiogénesis como bevacizumab(11), o bien, dependiendo de sus características genéticas, anticuerpos anti-PD1 (pembrolizumab)(12). La respuesta a la terapia no solo está relacionada con la etapa y el tipo histológico del cáncer, sino también al desarrollo de quimiorresistencia(13,14), el cual lamentablemente es un fenómeno frecuente en las pacientes con COE, ya que aproximadamente un 80% de las pacientes con COE avanzado pueden experimentar recurrencia asociada a quimiorresistencia(15).
PRINCIPALES MECANISMOS DE QUIMIORRESISTENCIA DEL COE
Si bien los mecanismos exactos que promueven la quimiorresistencia en COE no se encuentran completamente caracterizados, existen numerosos procesos que promueven este proceso. Algunos ejemplos son el aumento de la expresión de transportadores de eflujo (los que expulsan quimioterapéuticos de las células tumorales), la activación de oncogenes que promueven la señalización oncogénica, el silenciamiento e inhibición de genes y proteínas supresoras de tumor, alteración del metabolismo mitocondrial, disminución de la reparación del DNA celular, activación del proceso de transición epitelio mesénquima (EMT) y señalización a través de exosomas, entre otros(16).
TRANSPORTADORES DE LA FAMILIA ABC
Una causa bien establecida de resistencia a la quimioterapia es el aumento de la expresión de transportadores miembros de la familia ATP-binding cassette (ABC), varios de los cuales funcionan como bombas de eflujo de fármacos, expulsándolos de las células(17). Uno de los transportadores ABC más estudiados es ABCB1 (también conocido como p-glicoproteína o multidrug resistance protein 1), involucrado en el eflujo de paclitaxel y docetaxel (ambos taxanos usados como quimioterapia de primera línea para COE) y cuya sobreexpresión ha sido asociada a pobre pronóstico en pacientes con cáncer ovárico(18). Adicionalmente, se ha visto que este transportador aumenta en respuesta a cisplatino y paclitaxel en células de COE(19). Se ha visto que ABCB1 está ausente o es pobremente detectado en tejidos de pacientes con COE que no han sido tratados con quimioterapia y cuya presencia aumenta posterior a someterse a ésta(20), mostrando una relación inversa entre la expresión de ABCB1 y el pronóstico de las pacientes(21). Por otra parte, se ha descrito que células iniciadoras de tumor de COE que poseen características troncales y conocida resistencia a las terapias antitumorales, sobreexpresan los transportadores ABCB1 y ABCG2(22).
Toda esta evidencia sugiere que la inhibición de estos transportadores es un tema crucial de estudio para superar la resistencia a la quimioterapia en las pacientes con COE.
PROCESO DE TRANSICIÓN EPITELIO MESÉNQUIMA (EMT)
En línea con la idea anterior, el proceso de transición epitelio mesénquima (EMT) y la presencia de células iniciadoras de tumor (stem cells) juegan un rol importante en la quimiorresistencia y metástasis, ya que son una subpoblación de células malignas auto renovables que dirigen la iniciación de un tumor y su progresión(23). EMT es un proceso que permite que la célula epitelial (que normalmente interactúa con la membrana basal) cambie a un fenotipo mesenquimal que aumenta su capacidad migratoria, invasividad y resistencia a la muerte celular programada (apoptosis), entre otras características(24). EMT es un proceso característico en las células iniciadoras de tumor. Estudios han mostrado que esta población está implicada en la progresión del COE y desarrollo de quimiorresistencia(25). Por ejemplo, células de COE con características mesenquimales (ya que expresan proteínas de EMT como vimentina) muestran una pérdida de respuesta al tratamiento con carboplatino(26). Además, se encuentra reportado que las proteínas de EMT Snail y Slug aumentan la transcripción de transportadores ABC relacionado con el eflujo de fármacos(27,28). Estudios en células de COE tratadas con cisplatino muestran que esta quimioterapia produce la inducción de la señalización celular asociada al proceso de EMT, produciendo un aumento de la capacidad migratoria y favoreciendo un ambiente proinflamatorio, la desdiferenciación celular y quimiorresistencia de células de COE(23). Estos cambios celulares tendrían como propósito favorecer la adaptación de las células tumorales frente al estímulo hostil de la quimioterapia.
ROL DE LA INFLAMACIÓN EN EL COE
Muchos de los mecanismos de resistencia a la quimioterapia (incluyendo EMT y modulación de transportadores de eflujo) pueden ser favorecidos por la señalización celular activada por la inflamación, por lo que actualmente este proceso es considerado clave en el desarrollo y progresión del cáncer(29). La inflamación crónica se ha relacionado a un aumento del riesgo de cáncer, favoreciendo la proliferación celular y reduciendo la reparación del DNA(30) y suplementando moléculas activas al microambiente tumoral, incluyendo factores de crecimiento que favorecen la señalización de proliferación, sobrevivencia, disminuyen la muerte celular, factores proangiogénicos, enzimas que modifican la matriz extracelular y que facilitan la angiogénesis, invasión y metástasis, e inducen señales que activan el proceso de EMT(29).
Una molécula clave para la producción de mediadores inflamatorios es el ácido araquidónico, presente en las membranas celulares. Posterior a irritación o injuria, el ácido araquidónico es liberado y oxigenado por las enzimas ciclooxigenasas (COX) y lipoxigenasa- 5 (LOX-5), lo que produce mediadores inflamatorios(31). Existen 2 clases de enzimas COX: COX-1 y COX-2, las que están involucradas en la formación de prostaglandinas y tromboxano A2, ambos derivados del ácido araquidónico. Prostaglandina E2 (PGE2) ha mostrado una influencia significante sobre la adhesión, migración e invasión de células de cáncer(31). Algunos estudios realizados en fibroblastos y células de cáncer colorrectal mostraron que PGE2 promueve la señalización tumoral (vía Wnt/beta catenina) y estimula la producción de factores angiogénicos como VEGF(32).
En COE no solo hay una desregulación de COX- 2(33), sino también una desregulación selectiva de COX-1(34), sugiriendo que ambas enzimas (COX- 1 y COX-2) son fuentes de PGE2. Las células de COE inducen la expresión de COX-2 bajo ciertos estímulos, por ejemplo, bajo la estimulación con factores de crecimiento, los cuales son encontrados frecuentemente en el microambiente tumoral(33). Por consiguiente, en COE la inhibición de tanto COX-1 como COX-2 (y la disminución de la síntesis de PGE2) pareciera tener un mayor beneficio comparado con la inhibición selective de solo una de estas enzimas.
El uso de fármacos que controlen los procesos inflamatorios en el contexto del cáncer podrían tener un potencial beneficio como tratamientos complementarios.
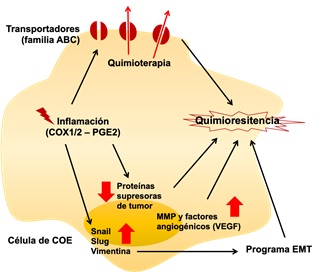
Figura 1. Esquema resumen de algunos de los mecanismos de quimiorresistencia descritos en las células de COE.
EMT: transición epitelio-mesénquima
MMP: metaloproteinasas
PGE2: prostaglandina E2
Snail, slug: factores transcripcionales que promueven el proceso de EMT
Vimentina: proteína de filamento altamente expresada en las células con EMT
REPROPÓSITO DE FÁRMACOS EN EL COE: METFORMINA
El uso de fármacos existentes con nuevos usos terapéuticos puede ser clave para el desarrollo de nuevas estrategias terapéuticas para el COE. Fármacos como las biguanidas, los antinflamatorios no esteroidales (AINES) y compuestos antioxidantes han mostrado importantes efectos antitumorales(35) fundamentalmente en estudios de cohorte retrospectiva, así como posteriormente al ser usados en modelos in vitro e in vivo de cáncer ovárico. Esta estrategia, a diferencia del desarrollo de nuevos fármacos, es mucho más barata, segura y puede ser útil para mejorar los efectos de la quimioterapia.
La metformina es un fármaco ampliamente usado para el tratamiento de desórdenes metabólicos como diabetes tipo 2, síndrome metabólico o síndrome de ovario poliquístico(36-38). Sus propiedades antitumorales fueron evidenciadas por primera vez en un estudio escocés que encontró que el uso de metformina disminuye el riesgo de desarrollar cáncer en pacientes con diabetes tipo 2(39). El efecto antitumoral de metformina en cáncer ovárico también ha sido estudiado, mostrando un efecto protector incluso en pacientes no diabéticas(40). Metformina entra a la célula a través de transportadores orgánicos catiónicos (OCTs) y transportadores de extrusión de fármacos y toxinas(41). Debido a que las células de ovario expresan OCTs(42), éstas podrían ser un tejido susceptible a la acción de metformina.
Los efectos antitumorales de metformina pueden ser explicados por acciones directas e indirectas. Por una parte, metformina disminuye la hiperglicemia e hiperinsulinemia(43), condiciones que favorecen el crecimiento tumoral y están asociadas con una mayor incidencia de cáncer(44,45). Por otra parte, los efectos antitumorales directos de metformina son pleiotrópicos e involucran múltiples blancos celulares. Uno de los más estudiados es la proteína quinasa activada por adenosina monofosfato (AMPK) que es un sensor energético celular(46). Molecularmente, metformina inhibe la producción de ATP mitocondrial (la mayor fuente energética celular) con una consecuente inhibición de la vía celular mammalian target of rapamycin (mTOR), que regula la señalización relacionada con crecimiento y supervivencia celular)(47). Adicionalmente, metformina regula la proteína 1 de unión a elementos reguladores de esterol (SREBP1)(48), lo que disminuye la biosíntesis de ácidos grasos y colesterol endógeno. Esta disminución de sustratos energéticos produce un swich metabólico en la célula de COE que disminuye su capacidad de proliferación y migración por disminución de múltiples proteínas que favorecen estos procesos tumorales, tales como c-MYC, ciclina D1 y metaloproteinasas entre otras(49,50). Además, se ha mostrado que metformina interfiere en la señalización de factores de crecimiento(51), así como también disminuye la resistencia a cisplatino en modelos in vitro e in vivo de COE, afectando particularmente al fenotipo de células iniciadoras de tumores(52).
La evidencia entregada en los estudios poblacionales también sugiere fuertemente que el uso de metformina sería beneficioso para los pacientes con COE. Los grupos de Wang(53) y Tseng(54) estudiaron cohortes de más de 500 mujeres chinas. En el primer trabajo se estudiaron 4 grupos de pacientes con cáncer ovárico: diabéticas usuarias de metformina, diabéticas no usuarias de metformina, diabéticas que descontinuaron el uso de metformina y pacientes con cáncer ovárico no diabéticas. Se observó una mayor sobrevivencia libre de progresión en el grupo tratado con metformina comparado con los otros grupos (40 vs 18.2 vs 28 vs 23.3 meses respectivamente). Por otra parte, Bar(55) y cols. obtuvieron resultados similares en un estudio de cohorte israelí de 143 pacientes, en la que concluyeron que metformina se asoció a una mayor sobrevida libre de recurrencia de cáncer ovárico (hazard ratio (HR): 0.372, con un 95% de intervalo de confianza (IC 95%) de 0.114–0.968). Otro estudio realizado en cohorte estadounidense también mostró que las pacientes con cáncer ovárico usuarias de metformina tuvieron mayor tasa de supervivencia a 5 años comparado con las pacientes diabéticas no usuarias (67% vs 47%)(56). Frente a la vasta y variada evidencia, una revisión sistemática reciente, que compiló el resultado de seis estudios de incidencia y seis de pronóstico de cáncer ovárico en pacientes usuarias de metformina, concluyó que efectivamente el uso de metformina fue asociado a una menor incidencia y mejor pronóstico de las pacientes diabéticas con cáncer ovárico(57).
Respecto al efecto de la ingesta de metformina directamente en el tejido tumoral, un reporte preliminar de nuestro grupo mostró que pacientes usuarias de metformina con tumores ováricos borderline (estadio previo al COE) presentaron menores niveles de oncoproteínas en sus biopsias, comparadas con las pacientes no usuarias de metformina(49). De forma similar, se realizó un estudio en pacientes con cáncer mamario, el que testeó el uso neoadyuvante de metformina (500 mg tres veces al día, por al menos dos semanas antes de la cirugía). Al comparar las biopsias tomadas antes y después del tratamiento, los investigadores evidenciaron una disminución en proteínas involucradas en la progresión tumoral, tales como la activación del receptor de insulina y de vías protumorales como PI3K-AKT y MAPK- ERK, así como también de la enzima acetil coenzima A carboxilasa (implicada en el metabolismo cellular)(58). Por otra parte, un estudio realizado en una cohorte retrospectiva de pacientes con leucemia linfoblástica aguda mostró que el uso combinado de metformina y quimioterapia aumentó la sobrevivencia de los pacientes, comparado con el grupo tratado sólo con quimioterapia, especialmente en el grupo que tenía mayores niveles de expresión de ABCB1(59).
Todos estos antecedentes indican que es necesario considerar y estudiar los efectos de antitumorales y quimiosensibilizantes de metformina en células de COE en dosis fisiológicas, similar a la concentración sanguínea alcanzada en las pacientes usuarias de este fármaco.
ROL DE LOS ANTIINFLAMATORIOS NO ESTEROIDALES (AINES) EN CÁNCER
Los AINES son fármacos ampliamente usados para reducir la inflamación, el dolor y la fiebre(60). El mecanismo de acción de los AINES es la inhibición de las enzimas COX-1 y COX-2 y por consiguiente, la síntesis de mediadores inflamatorios como PG(60). El uso prolongado de AINES ha sido asociado a una disminución de la incidencia en cánceres epiteliales(61). Se postula que una explicación a este fenómeno es que la inflamación crónica promueve la carcinogénesis y progresión del cáncer, debido a su conocido efecto sobre la inducción de la proliferación, angiogénesis, potencial metastásico y quimiorresistencia(62). Es así que el uso de AINES podría ser beneficioso en el contexto del cáncer, principalmente debido a sus efectos antiinflamatorios. El tratamiento con cisplatino induce la muerte masiva de las células tumorales, lo que se acompaña de una gran liberación de PGE2 que afecta a las células cercanas, promoviendo la programación troncal celular que favorecería la progresión del cáncer(63).
Wernli y colaboradores realizaron un estudio casocontrol en un grupo de pacientes británicas, concluyendo que el uso de AINEs fue asociado a un menor riesgo de desarrollar cáncer ovárico, pero particularmente en pacientes con mayor riesgo de éste (odds ratio (OR):0.47, IC 95%: 0.27–0.82), por ejemplo, pacientes nulíparas y no usuarias de anticonceptivos orales(64). Por otra parte, el grupo de Prizment(65) estudió una cohorte de 20 mil mujeres estadounidenses. Los resultados del estudio sugieren una asociación inversa entre la frecuencia de uso de aspirina y el riesgo de padecer cáncer ovárico, pero no encontró una asociación significativa con otros AINEs diferentes a la aspirina (HR: 0.65, IC 95%: 0.40-1.07). Frente a esta evidencia, una revisión sistemática realizada por Murphy(66) y colaboradores, analizó varios estudios con un total de 438 casos y más de 96 mil controles, mostrando que en los estudios de cohorte prospectiva el uso de AINES (diferentes a la aspirina) podrían reducir el riego de cáncer ovárico (risk ratio (RR): 0.88, IC 95%: 0.77–1.01).
En modelos celulares de laboratorio, particularmente en células de cáncer de vesícula biliar, el uso combinado de cisplatino y celecoxib (inhibidor selectivo de COX-2) previene la resistencia a cisplatino y restaura la sensibilidad a este fármaco in vivo e in vitro(67), mientras que en células de neuroblastoma, diclofenaco (un conocido AINES) potencia la apoptosis inducida por la quimioterapia mediante un aumento de p53(68). Particularmente en COE, se encuentra descrito que la sobreexpresión de las enzimas COX promueve el desarrollo de resistencia a cisplatino, mediante el favorecimiento del proceso de EMT(69). Otros investigadores han mostrado que el uso combinado de ketoprofeno y cisplatino en líneas celulares de cáncer de mama triple negativo produjo un aumento en la citotoxicidad del cisplatino, junto con la supresión de marcadores EMT como N-cadherina y vimentina(70). Resultados similares fueron observados en estudios que utilizaron células de cáncer pancreático, donde el uso de indometacina frenó el proceso de EMT inducido por el factor de crecimiento transformante-β, disminuyendo la expresión de N-cadherina y Snail(71), siendo éste un factor transcripcional involucrado en la diferenciación de células epiteliales a mesenquimales y favoreciendo la adquisición de la capacidad migratoria, tumorigénica e invasiva(72).
Respecto al uso de AINES para mejorar la sensibilidad a paclitaxel, una formulación de micelas cargadas con indometacina y paclitaxel fue testeada en un modelo in vivo de ratón con células de COE resistentes a este quimioterapéutico. El estudio mostró que la administración conjunta de indometacina y paclitaxel aumentó la actividad antitumoral de este último, produciendo una reducción en el tamaño tumoral del COE, la presencia de marcadores de proliferación (Ki- 67) y aumentando la apoptosis del tejido tumoral(73). Particularmente en cáncer ovárico, se ha descrito que los inhibidores de COX podrían sensibilizar a células de COE resistentes a taxanos(74). Por ejemplo, indometacina disminuye el crecimiento tumoral de células de COE in vivo e in vitro, implicando una disminución en el factor transcripcional E2F1(75). Existe evidencia reciente que indica que E2F1 se encuentra implicado en la activación de los transportadores de eflujo de la familia ABC, tales como ABCB1 y ABCG2(76,77), ambos transportadores implicados en la quimiorresistencia en COE.
POSIBLES BENEFICIOS DE LA COMBINACIÓN DE FÁRMACOS DE REPROPÓSITO
Lamentablemente, muchos de los estudios celulares que han mostrado efectos antitumorales de metformina en diferentes modelos de cáncer ovárico han utilizado concentraciones suprafisiológicas de este fármaco (concentraciones imposibles de alcanzar en sangre de pacientes)(41,78). De forma similar, los efectos antitumorales de los AINEs son observados utilizando dosis altas de estos medicamentos, difíciles de alcanzar en los pacientes. Para superar esta dificultad existen algunas alternativas, como es el uso combinado de fármacos, especialmente si tienen mecanismo de acción complementarios.
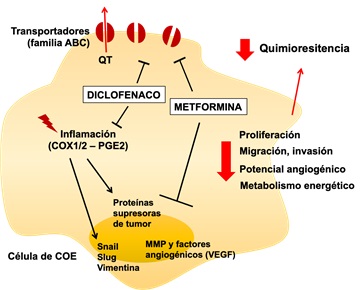
Figura 2. Esquema de los potenciales efectos de metformina y diclofenaco en las células de COE, donde se muestra el efecto inhibitorio de diclofenaco y metformina en la disminución de los transportadores de eflujo de drogas, así como también su efecto inhibitorio en moléculas inflamatorias y proteínas involucradas en progresión del cáncer.
El uso combinado de metformina y algunos AINES podría tener efectos aditivos o sinérgicos. Tal como se describió anteriormente, ambos metformina y AINEs disminuyen importantes procesos en las células tumorales, tales como la sobrevivencia, proliferación, migración e invasión, lo que se traduce en que su uso podría disminuir el potencial de progresión y diseminación de las células de COE. Desde el punto de vista metabólico, tanto metformina como diclofenaco regulan el metabolismo energético: metformina inhibe la actividad mitocondrial, disminuyendo la producción de ATP (forzando a las células a depender de otras fuentes energéticas, como la glicólisis), mientras que diclofenaco (otro AINEs) reduce la tasa glicolítica y la utilización de lactato como fuente energética. Por consiguiente, estos fármacos parecen tener mecanismos complementarios para frenar las adaptaciones metabólicas de las células tumorales y podrían potenciar los efectos citotóxicos de la quimioterapia. Adicionalmente, existen antecedentes de que metformina y diclofenaco por separado inhiben el proceso de EMT en células de COE(79), así como la expresión del transportador ABCB1 en células de cáncer mamario y colorrectal resistentes a múltiples fármacos(80,81), por lo que su uso combinado podría tener efectos sinérgicos o complementarios, inhibiendo la capacidad migratoria e invasora y la quimiosensibilización de células de COE.
CONCLUSIONES Y PROYECCIÓN
Existe bastante evidencia en estudios de cohorte retrospectiva que muestran que el uso de algunos fármacos podría tener beneficios en la incidencia y mortalidad por cáncer ovárico, tales como la metformina y AINEs. Además, existe una vasta cantidad de estudios in vitro que muestran que estos fármacos tienen efectos antitumorales directos en células de COE, por lo que actualmente están siendo estudiados en el contexto del desarrollo de nuevas terapias complementarias para esta patología. La elevada concentración de estos fármacos que se necesita para alcanzar los mejores efectos antitumorales dificulta su proyección como futura terapia. En este contexto, nuestro grupo se encuentra estudiando el uso combinado de fármacos de repropósito para aumentar la sensibilidad a la quimioterapia de las células de COE, estrategia que pretendemos pueda superar esta dificultad y permita observar efectos antitumorales a menores concentraciones de estos medicamentos. Parte de esta temática está siendo abordada en el reciente Proyecto Semilla de nuestro Hospital adjudicado este año, el que pretende estudiar, si el uso combinado de metformina y diclofenaco en bajas concentraciones puede actuar como sensibilizante a la quimioterapia con cisplatino; así como también, si puede afectar negativamente diferentes procesos tumorales tales como su capacidad proliferativa, migratoria e invasora de las células de COE.
REFERENCIAS
1. The American Cancer Society. Key Statistics for Ovarian Cancer 2021 [Internet]. Acceso en 30 de mayo de 2023. Disponible en: https:// bit.ly/452Hzj0.
2. Cancer Research UK. Ovarian cancer statistics 2021 [Internet]. Acceso en 30 de mayo de 2023. Disponible en: https://bit.ly/3OsQeWK
3. Ministerio de Salud de Chile. Plan Nacional de Cáncer 2018 - 2028. [Internet]. Acceso en 30 de mayo de 2023. Disponible en: https:// bit.ly/44GPZwW
4. Cuello FM. GES en cancer de ovario epitelial: un avance sanitario necesario, pero no exento de riesgos y dificultades futuras. Rev Chil Obstetr y Ginecol 2013;78:161-6.
5. Van Calster B, Timmerman D, Lu C, Suykens JA, Valentin L, Van Holsbeke C et al. Preoperative diagnosis of ovarian tumors using Bayesian kernel-based methods. Ultrasound Obstet Gynecol 2007;29:496-504.
6. Scholler N, Urban N. CA125 in ovarian cancer. Biomark Med 2007;1:513-23.
7. Dai C, Zheng Y, Li Y, Tian T, Wang M, Xu P et al. Prognostic values of HE4 expression in patients with cancer: a meta-analysis. Cancer Manag Res 2018;10:4491-500.
8. Ministerio de Salud de Chile. Guía AUGE Cáncer de Ovario Epitelial 2013. [Internet]. Acceso en 30 de mayo de 2023. Disponible en: https://bit.ly/3KdGLzU
9. Abal M, Andreu JM, Barasoain I. Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action. Curr Cancer Drug Targets 2003;3:193-203.
10. Fuertes MA, Alonso C, Pérez JM. Biochemical modulation of cisplatin mechanisms of action: enhancement of antitumor activity and circumvention of drug resistance. Chemical Reviews 2003;103:645-62.
11. Informe de evaluación científica basada en la evidencia disponible. Condición de salud: cáncer de ovario epitelial. Tecnología sanitaria evaluada: Bevacizumab y trabectedina. [Internet]. 2017. Acceso en 30 de mayo de 2023. Disponible en: https://bit.ly/44XytnO.
12. U.S. Food and Drug Administration. FDA approves first cancer treatment for any solid tumor with a specific genetic feature 2017 [Internet]. Acceso en 30 de mayo de 2023. Disponible en: https://bit.ly/43MdMtY.
13. Glasgow MA, Argenta P, Abrahante JE, Shetty M, Talukdar S, Croonquist PA et al. Biological insights into chemotherapy resistance in ovarian cancer. Int J Mol Sci 2019;20: 2131.
14. Sugiyama T, Kamura T, Kigawa J, Terakawa N, Kikuchi Y, Kita T et al. Clinical characteristics of clear cell carcinoma of the ovary: a distinct histologic type with poor prognosis and resistance to platinum-based chemotherapy. Cancer 2000;88:2584-9.
15. Agarwal R, Kaye SB. Ovarian cancer: strategies for overcoming resistance to chemotherapy. Nat Rev Cancer 2003;3:502-16.
16. Zheng HC. The molecular mechanisms of chemoresistance in cancers. Oncotarget 2017;8:59950-64.
17. Choi CH. ABC transporters as multidrug resistance mechanisms and the development of chemosensitizers for their reversal. Cancer Cell Int 2005;5:30.
18. Sun S, Cai J, Yang Q, Zhu Y, Zhao S, Wang Z. Prognostic value and implication for chemotherapy treatment of abcb1 in epithelial ovarian cancer: a meta-analysis. PLoS One 2016;11:e0166058.
19. Schondorf T, Neumann R, Benz C, Becker M, Riffelmann M, Gohring UJ et al. Cisplatin, doxorubicin and paclitaxel induce mdr1 gene transcription in ovarian cancer cell lines. Recent Results Cancer Res 2003;161:111-6.
20. Penson RT, Oliva E, Skates SJ, Glyptis T, Fuller AF, Goodman A et al. Expression of multidrug resistance-1 protein inversely correlates with paclitaxel response and survival in ovarian cancer patients: a study in serial samples. Gynecol Oncol 2004;93:98-106.
21. Yakirevich E, Sabo E, Naroditsky I, Sova Y, Lavie O, Resnick MB. Multidrug resistance-related phenotype and apoptosisrelated protein expression in ovarian serous carcinomas. Gynecol Oncol 2006;100:152-9.
22. Kenda Suster N, Virant-Klun I. Presence and role of stem cells in ovarian cancer. World J Stem Cells 2019;11:383-97.
23. Rohnalter V, Roth K, Finkernagel F, Adhikary T, Obert J, Dorzweiler K et al. A multi-stage process including transient polyploidization and EMT precedes the emergence of chemoresistent ovarian carcinoma cells with a dedifferentiated and pro-inflammatory secretory phenotype. Oncotarget 2015;6:40005-25.
24. Kalluri R, Weinberg RA. The basics of epithelial- mesenchymal transition. J Clin Invest 2009;119:1420-8.
25. Kim S, Han Y, Kim SI, Kim HS, Kim SJ, Song YS. Tumor evolution and chemoresistance in ovarian cancer. NPJ Precis Oncol 2018;2:20.
26. Gonzalez VD, Samusik N, Chen TJ, Savig ES, Aghaeepour N, Quigley DA et al. Commonly occurring cell subsets in high-grade serous ovarian tumors identified by single-cell mass cytometry. Cell Rep 2018;22:1875-88.
27. Loret N, Denys H, Tummers P, Berx G. The role of epithelial-to-mesenchymal plasticity in ovarian cancer progression and therapy resistance. Cancers (Basel) 2019;11:338.
28. Saxena M, Stephens MA, Pathak H, Rangarajan A. Transcription factors that mediate epithelial-mesenchymal transition lead to multidrug resistance by upregulating ABC transporters. Cell Death Dis 2011;2:e179.
29. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011;144:646-74.
30. Guo X, Oshima H, Kitmura T, Taketo MM, Oshima M. Stromal fibroblasts activated by tumor cells promote angiogenesis in mouse gastric cancer. J Biol Chem 2008;283:19864-71.
31. Aoki T, Narumiya S. Prostaglandins and chronic inflammation. Trends Pharmacol Sci 2012;33:304-11.
32. Nakanishi M, Rosenberg DW. Multifaceted roles of PGE2 in inflammation and cancer. Semin Immunopathol 2013;35:123-37.
33. Garrido MP, Hurtado I, Valenzuela-Valderrama M, Salvatierra R, Hernandez A, Vega M et al. NGF-Enhanced vasculogenic properties of epithelial ovarian cancer cells is reduced by inhibition of the COX-2/PGE2 signaling axis. Cancers (Basel) 2019;11:1970.
34. Gupta RA, Tejada LV, Tong BJ, Das SK, Morrow JD, Dey SK et al. Cyclooxygenase-1 is overexpressed and promotes angiogenic growth factor production in ovarian cancer. Cancer Res 2003;63:906-11.
35. Garrido MP, Fredes AN, Lobos-Gonzalez L, Valenzuela-Valderrama M, Vera DB, Romero C. Current treatments and new possible complementary therapies for epithelial ovarian cancer. Biomedicines 2021;10:77.
36. Kelley KW, Carroll DG, Meyer A. A review of current treatment strategies for gestational diabetes mellitus. Drugs Context 2015;4:212282.
37. Scarpello JH, Howlett HC. Metformin therapy and clinical uses. Diab Vasc Dis Res 2008;5:157-67.
38. Mathur R, Alexander CJ, Yano J, Trivax B, Azziz R. Use of metformin in polycystic ovary syndrome. Am J Obstet Gynecol 2008;199:596-609.
39. Evans JM, Donnelly LA, Emslie-Smith AM, Alessi DR, Morris AD. Metformin and reduced risk of cancer in diabetic patients. BMJ 2005;330:1304-5.
40. Romero IL, McCormick A, McEwen KA, Park S, Karrison T, Yamada SD et al. Relationship of type II diabetes and metformin use to ovarian cancer progression, survival, and chemosensitivity. Obstet Gynecol 2012;119:61- 7.
41. Gong L, Goswami S, Giacomini KM, Altman RB, Klein TE. Metformin pathways: pharmacokinetics and pharmacodynamics. Pharmacogenet Genomics 2013;22:820-7.
42. Ota K, Ito K, Akahira J, Sato N, Onogawa T, Moriya T et al. Expression of organic cation transporter SLC22A16 in human epithelial ovarian cancer: a possible role of the adriamycin importer. Int J Gynecol Pathol 2007;26:334-40.
43. Morris A. Diabetes: Systemic effects of metformin revealed. Nat Rev Endocrinol 2017;13:562.
44. Perseghin G, Calori G, Lattuada G, Ragogna F, Dugnani E, Garancini MP et al. Insulin resistance/hyperinsulinemia and cancer mortality: the Cremona study at the 15th year of follow-up. Acta Diabetol 2012;49:421-8.
45. Ryu TY, Park J, Scherer PE. Hyperglycemia as a risk factor for cancer progression. Diabetes Metab J 2014;38:330-6.
46. Hardie DG, Ross FA, Hawley SA. AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat Rev Mol Cell Biol 2012;13:251-62.
47. Li C, Liu VW, Chan DW, Yao KM, Ngan HY. LY294002 and metformin cooperatively enhance the inhibition of growth and the induction of apoptosis of ovarian cancer cells. Int J Gynecol Cancer 2012;22:15-22.
48. Li Y, Xu S, Mihaylova MM, Zheng B, Hou X, Jiang B et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in dietinduced insulin-resistant mice. Cell Metab 2011;13:376-88.
49. Garrido MP, Salvatierra R, Valenzuela-Valderrama M, Vallejos C, Bruneau N, Hernandez A et al. Metformin eeduces NGF-Induced tumour promoter effects in epithelial ovarian cancer cells. Pharmaceuticals (Basel) 2020;13:315.
50. Gwak H, Kim Y, An H, Dhanasekaran DN, Song YS. Metformin induces degradation of cyclin D1 via AMPK/GSK3beta axis in ovarian cancer. Mol Carcinog 2017;56:349-58.
51. Garrido MP, Vera C, Vega M, Quest AFG, Romero C. Metformin prevents nerve growth factor-dependent proliferative and proangiogenic effects in epithelial ovarian cancer cells and endothelial cells. Ther Adv Med Oncol 2018;10:1758835918770984.
52. Rattan R, Graham RP, Maguire JL, Giri S, Shridhar V. Metformin suppresses ovarian cancer growth and metastasis with enhancement of cisplatin cytotoxicity in vivo. Neoplasia 2011;13:483-91.
53. Wang SB, Lei KJ, Liu JP, Jia YM. Continuous use of metformin can improve survival in type 2 diabetic patients with ovarian cancer: A retrospective study. Medicine (Baltimore) 2017;96:e7605.
54. Tseng CH. Metformin reduces ovarian cancer risk in Taiwanese women with type 2 diabetes mellitus. Diabetes Metab Res Rev 2015;31:619- 26.
55. Bar D, Lavie O, Stein N, Feferkorn I, Shai A. The effect of metabolic comorbidities and commonly used drugs on the prognosis of patients with ovarian cancer. Eur J Obstet Gynecol Reprod Biol 2016;207:227-31.
56. Kumar S, Meuter A, Thapa P, Langstraat C, Giri S, Chien J et al. Metformin intake is associated with better survival in ovarian cancer: a case-control study. Cancer 2013;119:555-62.
57. Shi J, Liu B, Wang H, Zhang T, Yang L. Association of metformin use with ovarian cancer incidence and prognosis: a systematic review and meta-analysis. Int J Gynecol Cancer 2019;29:140-6.
58. Dowling RJ, Niraula S, Chang MC, Done SJ, Ennis M, McCready DR et al. Changes in insulin receptor signaling underlie neoadjuvant metformin administration in breast cancer: a prospective window of opportunity neoadjuvant study. Breast Cancer Res 2015;17:32.
59. Ramos-Penafiel C, Olarte-Carrillo I, Ceron- Maldonado R, Rozen-Fuller E, Kassack-Ipina JJ, Melendez-Mier G et al. Effect of metformin on the survival of patients with ALL who express high levels of the ABCB1 drug resistance gene. J Transl Med 2018;16:245.
60. Ghlichloo I, Gerriets V. Nonsteroidal Antiinflammatory Drugs (NSAIDs). 2020.
61. Kim S, Shore DL, Wilson LE, Sanniez EI, Kim JH, Taylor JA et al. Lifetime use of nonsteroidal anti-inflammatory drugs and breast cancer risk: results from a prospective study of women with a sister with breast cancer. BMC Cancer 2015;15:960.
62. Hilovska L, Jendzelovsky R, Fedorocko P. Potency of non-steroidal anti-inflammatory drugs in chemotherapy. Mol Clin Oncol 2014;3:3-12.
63. Wang D, Fu L, Sun H, Guo L, DuBois RN. Prostaglandin E2 promotes colorectal cancer stem cell expansion and metastasis in mice. Gastroenterology 2015;149:1884-95 e4.
64. Wernli KJ, Newcomb PA, Hampton JM, Trentham-Dietz A, Egan KM. Inverse association of NSAID use and ovarian cancer in relation to oral contraceptive use and parity. Br J Cancer 2008;98:1781-3.
65. Prizment AE, Folsom AR, Anderson KE. Nonsteroidal anti-inflammatory drugs and risk for ovarian and endometrial cancers in the Iowa Women’s Health Study. Cancer Epidemiol Biomarkers Prev 2010;19:435-42.
66. Murphy MA, Trabert B, Yang HP, Park Y, Brinton LA, Hartge P et al. Non-steroidal anti- inflammatory drug use and ovarian cancer risk: findings from the NIH-AARP Diet and Health Study and systematic review. Cancer Causes Control 2012;23:1839-52.
67. Kurtova AV, Xiao J, Mo Q, Pazhanisamy S, Krasnow R, Lerner SP et al. Blocking PGE2-induced tumour repopulation abrogates bladder cancer chemoresistance. Nature 2015;517:209-13.
68. Lau L, Hansford LM, Cheng LS, Hang M, Baruchel S, Kaplan DR et al. Cyclooxygenase inhibitors modulate the p53/HDM2 pathway and enhance chemotherapy-induced apoptosis in neuroblastoma. Oncogene 2007;26:1920-31.
69. Deng L, Feng DQ, Ling B. Cyclooxygenase-2 promotes ovarian cancer cell migration and cisplatin resistance via regulating epithelial mesenchymal transition. J Zhejiang Univ Sci B 2020;21:315-26.
70. Ma ZY, Song XQ, Hu JJ, Wang DB, Ding XJ, Liu RP et al. Ketoplatin in triple-negative breast cancer cells MDA-MB-231: High efficacy and low toxicity, and positive impact on inflammatory microenvironment. Biochem Pharmacol 2021;188:114523.
71. Sezer G, Onses MS, Sakir M, Sahin F, Camdal A, Sezer Z et al. Indomethacin prevents TGFbeta- induced epithelial-to-mesenchymal transition in pancreatic cancer cells; evidence by Raman spectroscopy. Spectrochim Acta A Mol Biomol Spectrosc 2022;280:121493.
72. Cano A, Perez-Moreno MA, Rodrigo I, Locascio A, Blanco MJ, del Barrio MG et al. The transcription factor snail controls epithelialmesenchymal transitions by repressing E-cadherin expression. Nat Cell Biol 2000;2:76-83.
73. Wang S, Tan X, Li S, Zhou Y, Geng P, Hua A et al. Indomethacin-based stimuli-responsive micelles combined with paclitaxel to 226 Revista Hospital Clínico Universidad de Chile overcome multidrug resistance. Oncotarget 2017;8:111281-94.
74. Lee JP, Hahn HS, Hwang SJ, Choi JY, Park JS, Lee IH et al. Selective cyclooxygenase inhibitors increase paclitaxel sensitivity in taxane-resistant ovarian cancer by suppressing P-glycoprotein expression. J Gynecol Oncol 2013;24:273-9.
75. Valle BL, D’Souza T, Becker KG, Wood WH, 3rd, Zhang Y, Wersto RP et al. Non-steroidal anti-inflammatory drugs decrease E2F1 expression and inhibit cell growth in ovarian cancer cells. PLoS One 2013;8:e61836.
76. Rosenfeldt MT, Bell LA, Long JS, O’Prey J, Nixon C, Roberts F et al. E2F1 drives chemotherapeutic drug resistance via ABCG2. Oncogene 2014;33:4164-72.
77. Yan LH, Wei WY, Cao WL, Zhang XS, Xie YB, Xiao Q. Overexpression of E2F1 in human gastric carcinoma is involved in anti-cancer drug resistance. BMC Cancer 2014;14:904.
78. Duong JK, Kumar SS, Furlong TJ, Kirkpatrick CM, Graham GG, Greenfield JR et al. The pharmacokinetics of metformin and concentrations of haemoglobin A1C and lactate in Indigenous and non-Indigenous Australians with type 2 diabetes mellitus. Br J Clin Pharmacol 2014;79:617-23.
79. Zhang R, Zhang P, Wang H, Hou D, Li W, Xiao G et al. Inhibitory effects of metformin at low concentration on epithelial-mesenchymal transition of CD44(+)CD117(+) ovarian cancer stem cells. Stem Cell Res Ther 2015;6:262.
80. Kim HG, Hien TT, Han EH, Hwang YP, Choi JH, Kang KW et al. Metformin inhibits P-glycoprotein expression via the NF-kappaB pathway and CRE transcriptional activity through AMPK activation. Br J Pharmacol 2011;162:1096-108.
81. Takara K, Hayashi R, Kokufu M, Yamamoto K, Kitada N, Ohnishi N et al. Effects of nonsteroidal anti-inflammatory drugs on the expression and function of P-glycoprotein/ MDR1 in Caco-2 cells. Drug Chem Toxicol 2009;32:332-7.
Correspondencia:
 Dra. Maritza P. Garrido Palma
Dra. Maritza P. Garrido Palma
 Laboratorio de Endocrinología y Biología de la Reproducción, Depto. Obstetricia y Ginecología, Hospital Clínico Universidad de Chile
Laboratorio de Endocrinología y Biología de la Reproducción, Depto. Obstetricia y Ginecología, Hospital Clínico Universidad de Chile
 [email protected]
[email protected]
 562 2978 8460
562 2978 8460