Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Cáncer de piel no melanoma: carcinoma basocelular. Revisión de la literatura
Basal cell carcinoma (BCC) is the most common type of non-melanoma skin cancer, representing 80% of cases. Its incidence has increased due to population aging and sun exposure. Although it rarely metastasizes, its high prevalence places a significant burden on healthcare systems. Risk factors include UV radiation exposure, radiotherapy, genetic predisposition, immunosuppression, skin phototype, and previous BCC history, among others. BCC is classified into histopathological subtypes such as nodular, superficial and morpheaform, each with distinctive clinical characteristics. Diagnosis is made by clinical examination, dermatoscopy and biopsy. The main treatment is surgical excision, with options like micrographic surgery or Mohs surgery for high-risk lesions or critical locations. In selected cases, topical therapies and radiotherapy can be used. Long-term follow-up is crucial as patients with BCC have a high risk of developing new lesions. Prevention, early detection, and appropriate treatment are essential to reduce morbidity and mortality associated with BCC. Continuous efforts in education and research are needed to address this public health issue.
Keywords: basal cell carcinoma, carcinoma basocelular
Rev Hosp Clín Univ Chile 2025; 36: 201 - 14. DOI: 10.5354/2735-7996.2025.75432
Ian Orchard B., Tomás González A., Daniel Rappoport W., Patricio Gac E.,Vivian Parada F.
El cáncer de piel es la neoplasia maligna más frecuente a nivel mundial y su incidencia ha aumentado de forma significativa durante las últimas décadas, probablemente debido al envejecimiento de la población y la creciente exposición a la luz solar. Se puede clasificar en dos grandes grupos: melanoma y no melanoma(1).
El cáncer de piel no melanoma (CPNM) es considerablemente más frecuente que el melanoma. Dada su alta frecuencia, reviste una carga considerable para los sistemas de salud. Un estudio reveló que entre 2007 a 2011, el costo anual del tratamiento para CPNM en Estados Unidos fue de $4,8 billones de dólares(2).
El carcinoma basocelular (CBC) es el cáncer de piel más frecuente, correspondiendo a un 80% de los casos no melanoma. Es una neoplasia originada en células de la capa basal de la epidermis. Clínicamente tienden a presentarse como lesiones nodulares, indoloras, de crecimiento progresivo, localizadas principalmente en cabeza y cuello(3).
Es una neoplasia que puede actuar localmente de forma agresiva, con invasión y destrucción celular; sin embargo, con una tasa de metástasis sumamente baja (menor a 0.1% de los casos)(4,5). Un adecuado manejo de estas lesiones es fundamental. El diagnóstico de estas lesiones se basa en la evaluación clínica apoyada por dermatoscopía y estudio histológico, mientras que el pilar fundamental del tratamiento curativo corresponde a la resección quirúrgica.
Es sumamente importante que los médicos generales manejen conceptos básicos y fundamentales sobre el CBC, debido a su alta prevalencia y las implicancias clínicas asociadas. Es una patología prevenible, con factores de riesgo claramente identificados, sospecha diagnóstica clínica y variadas opciones terapéuticas que, siendo utilizadas a tiempo, permiten un excelente pronóstico.
EPIDEMIOLOGÍA
Se desconoce la cifra exacta de incidencia del CBC, pues no existen registros exactos de este tipo de neoplasia en la gran mayoría de los países. La Sociedad Americana de Cáncer estima que se diagnostican 2 millones de casos anualmente en Estados Unidos(6). En Reino Unido, se estima que la incidencia para el año 2025 será de 298.308 casos(7). En Chile no existen datos centralizados actualizados que permitan estimar su incidencia.
Su presentación es mayor en poblaciones de mayor edad: 100 veces más frecuente en personas de entre 55 y 75 años comparado con menores de 20 años(8). Sin embargo, en población joven, menor a 40 años, se ha observado un aumento considerable en el número de casos(9). Su incidencia es mayor en hombres que mujeres; sin embargo, la incidencia en este grupo también ha aumentado considerablemente en las últimas décadas.
Otro dato importante a considerar es que el CBC tiene una tasa de metástasis inferior al 0.1%%; sin embargo, como se mencionó en la introducción, es un cáncer localmente agresivo con destrucción celular importante que puede tener implicancias estéticas y funcionales.
FACTORES DE RIESGO
Radiación ultravioleta (UV)
La exposición a radiación UV es el principal factor de riesgo ambiental vinculado al desarrollo de cáncer de piel en cualquiera de sus formas y se relaciona directamente con un mayor riesgo de CBC. Esto se debe a que la radiación UV produce alteración en los dímeros de timina, generando alteraciones morfológicas en las hebras de ADN, favoreciendo la proliferación de estirpes celulares cancerígenas(10). No se ha definido exactamente el tipo, cantidad y tiempo de exposición requerido para elevar significativamente el riesgo. Diversos estudios han evidenciado que la exposición durante los primeros años de vida son, aparentemente, más definitorios que la de la adultez(11,12).
En la misma línea, se han visto variaciones en la incidencia según geografía y exposición solar. En Estados Unidos, aquellos estados ubicados cercanos al ecuador tienen una incidencia de al menos el doble que aquellos estados más lejanos(6). A nivel global ocurre algo similar. Por ejemplo, la incidencia en Australia es 40 veces mayor que la de Finlandia, país nórdico europeo, cuya exposición a radiación UV es considerablemente menor.(13,14)
Radiación ionizante
El uso de radioterapia, particularmente durante la infancia, se ha relacionado a mayor incidencia de CBC. Un estudio siguió a un grupo de personas que fueron expuestos a radioterapia y se observó que la incidencia de CBC fue 5 veces mayor a la esperada en la población general. En todos ellos, la lesión se ubicó en el sitio de radiación(15).
Genética
Existen algunas variantes en genes determinantes en la pigmentación de la piel que aumentan el riesgo de CBC, como lo son los genes del receptor de melanocortina-1 (MC1R), el homólogo humano de la proteína señalizadora del agutí (ASIP) y el de tirosinasa (TYR)(16,17).
Además, existen algunos desórdenes genéticos hereditarios que se vinculan a mayor incidencia de CBC y a menor edad. Ejemplo de ello son el síndrome del carcinoma basocelular nevoide, síndrome de Rombo, síndrome de Bazex-Dupré-Christol, xeroderma pigmentoso, entre otros.
Inmunosupresión
Otro factor de riesgo importante es la inmunosupresión; pacientes trasplantados de órgano sólido que se ven sometidos a inmunosupresión farmacológica de forma prolongada, así como pacientes VIH no tratados han mostrado tener mayor tasa de cáncer de piel no melanoma; aumenta la incidencia tanto de CBC como de CEC, pero el aumento de éste último es considerablemente mayor (el riesgo de desarrollarlo es 100 veces mayor comparado con el resto de la población). Es importante notar que no solo aumenta la incidencia, sino que también se ha visto que estas lesiones se comportan con mayor agresividad y presentan mayor tasa de recurrencia(18,19).
Fototipo de piel
Pacientes con fototipos de piel más claros tienen mayor riesgo de desarrollar cáncer de piel. En particular, los fototipos de Fitzpatrick I, II y III (dependiendo de la población), poseen mayor riesgo de generar quemaduras solares, factor de riesgo para el desarrollo de un cáncer de piel. Un metaanálisis determinó que fototipos más claros, con piel que tiende a responder con quemaduras más que bronceado, tienen el doble de riesgo de desarrollar CBC(20).
Antecedente de cáncer de piel previo
Pacientes con antecedente de CBC previos tienen un mayor riesgo de desarrollar nuevamente el mismo tipo de neoplasia. Son células genéticamente iguales, expuestas a las mismas noxas y factores de riesgo a lo largo de la vida. Estudios retrospectivos han visto que aproximadamente el 40-50% de los pacientes con historia de CBC desarrollan una nueva lesión dentro de los primeros 5 años(21,22). Ahora bien, es importante notar que, si la primera neoplasia es un cáncer de piel distinto al basocelular, el riesgo de desarrollar un CBC es significativamente mayor(23).
Exposición crónica a arsénico
La ingesta crónica de aguas contaminadas, comida de mar o fármacos con contenido de arsénico pueden vincularse al desarrollo de CBC. Un estudio taiwanés evidenció que el riesgo de CBC era tres a cuatro veces mayor en personas vinculadas a mayor exposición a arsénico(24).
DIAGNÓSTICO
Clínica
El CBC puede presentarse de diferentes formas. Como se mencionó inicialmente, se localiza principalmente en región facial y cuello, zonas con mayor fotoexposición. Es habitual también su localización en tronco y es rara su presentación en zonas como genitales, región axilar, palmas y plantas.
Es frecuente que los pacientes interpreten la lesión como heridas o erosiones, pero al persistir en el tiempo o presentar difícil cicatrización, deciden consultar. En general, se presenta como lesiones solevantadas, superficie irregular, bordes mal definidos, con pequeños vasos visibles en su superficie. Pueden evolucionar con ulceraciones y pequeños sangrados. En general, no causan dolor, pero sí pueden manifestarse con prurito.
Subtipos histopatológicos
Existen distintos tipos de CBC, cada uno con sus particularidades clínicas e histopatológicas.
- Macronodular: También conocido como nodular. Es el subtipo más frecuente, dando cuenta de aproximadamente el 80% del total de CBC. Se ubica principalmente en región facial. Clínicamente se describe con una pápula firme, de coloración rojiza, aspecto brillante (conocido como “bordes perlados”) y telangiectasias visibles en la superficie de la lesión. Generalmente son de curso asintomático; sin embargo, pueden evolucionar con ulceración y sangrado(25). Histológicamente se caracteriza por presentar islas celulares con empalizadas periféricas de núcleos en los bordes del tumor. Generalmente tiene un comportamiento menos agresivo y un menor riesgo de recurrencia comparado con otros subtipos(26).
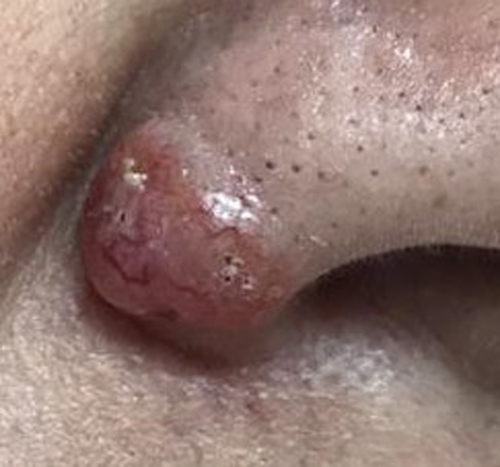
Figura 1. CBC macronodular. Lesión solevantada, con bordes perlados y telangectasias.
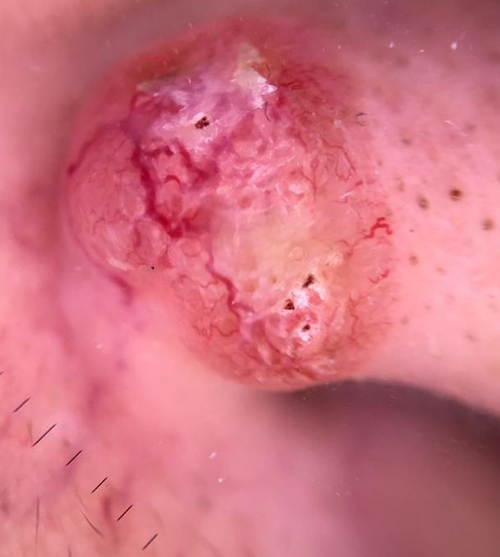
Figura 2. CBC macronodular, visión dermatoscópica. Se observan telangiectasias y ulceración dentro de la lesión.
- Micronodular: se caracteriza por componerse de múltiples nódulos pequeños. Si bien comparte algunas características clínicas con el macronodular, es importante destacar que este subtipo es considerado más agresivo, con mayor tendencia a invadir la dermis y, por ende, evidencia mayor tasa de recurrencia(25,27).
- Superficial: corresponde al 15% de los CBC. Su ubicación más característica es en tronco y es de crecimiento lento. Se presenta como máculas o placas delgadas, coloración rojo o rosado. Puede presentar atrofia al centro de la lesión y aumento de volumen hacia la periferia, con bordes perlados. Además, puede presentar manchas pequeñas de color más oscuro. Se debe sospechar en pacientes con “eccema” que no responde a tratamiento convencional(25,27). Histológicamente suele presentar un patrón de “cadena de perlas” que representa la conexión clara con la unión dermoepidérmica. Es importante mencionar que, para clasificar como superficial, la masa tumoral debe estar limitada a la epidermis, sin invasión dérmica(26).
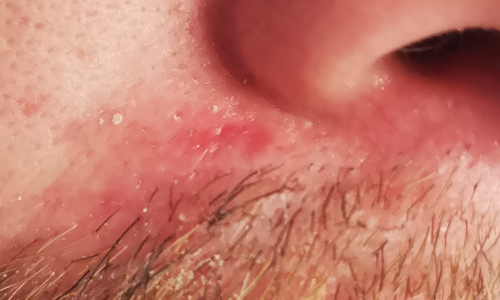
Figura 3. CBC superficial. Se observa mácula plana coloración rosada, con atrofia central y bordes perlados hacia periferia.
- Morfeiforme: representa entre 5 a 10% del total de casos. Son lesiones blandas, generalmente pápulas o placas atróficas, blanquecinas y bordes mal definidos(25). Se compone de delgadas hebras de células basales que invaden la dermis, rodeadas por un estroma fibroso denso. Es el subtipo más agresivo; presenta crecimiento acelerado y mayor tasa de metástasis (siendo esta aún baja)(28,29).
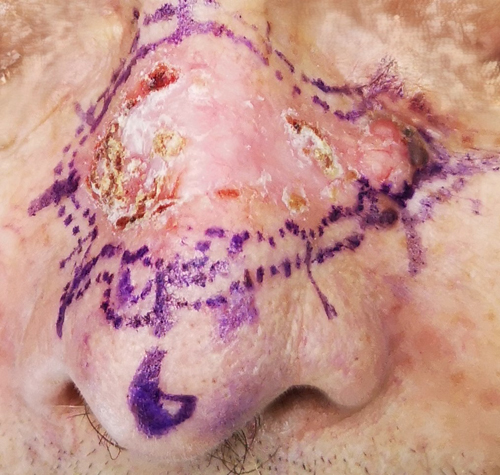
Figura 4. CBC morfeiforme. Se observa lesión atrófica, con vasos telangiectásicos en su interior y costras.
- Adenoquístico: es un subtipo menos frecuente, caracterizado histológicamente por la disposición de las células tumorales en patrones similares a estructuras glandulares. Tiende a ubicarse en región facial. No posee comportamiento agresivo, y tiene bajo riesgo de recurrencia(25,28).
- Basoescamoso: es un subtipo desafiante en cuanto a manejo, dado que es un tumor que presenta características, tanto de CBC como de carcinoma espinocelular (CEC). Histológicamente, puede surgir como una mezcla tanto de CBC y CEC adyacentes, o bien, como un tumor bifenotípico con metaplasia escamosa importante. Ahora bien, estudios genéticos han demostrado que las mutaciones en la vía Hedgehog son similares a los CBC, lo que permite suponer que estos tumores derivan del CBC, con posterior plasticidad fenotípica hacia células escamosas. Es importante recalcar que, en este caso, la tasa de metástasis es mayor, similar a la del CEC. Su clasificación y manejo son desafiantes debido a su naturaleza mixta(30).
- Infiltrativo: subtipo agresivo, caracterizado por su capacidad de invadir con mayor profundidad los tejidos adyacentes y, por lo tanto, mayor recurrencia post cirugía. Estudios han demostrado que este subtipo presenta una infiltración inmune sostenida, con una compleja interacción con el microambiente tumoral, contribuyendo a su comportamiento agresivo. Específicamente, se ha identificado que sus células malignas estimulan la angiogénesis y remodelación celular. En lo histológico, se caracteriza por la presencia de proyecciones espiculadas que invaden la profundidad del tejido, frecuentemente con compromiso perineural(27,28).
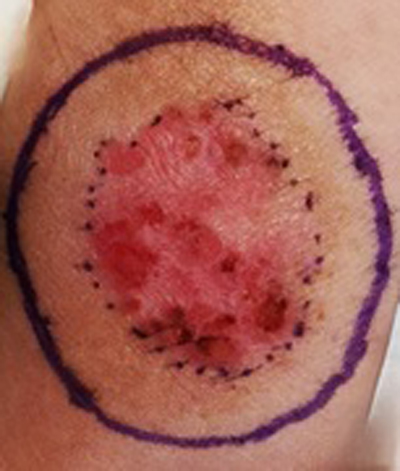
Figura 5. CBC Infiltrativo. Se observa lesión aplanada, heterogénea.
Es importante la diferenciación del subtipo histológico, dado que como se mencionó, existen algunos de comportamiento más agresivo, como el micronodular, infiltrativo y morfeiforme que pueden requerir enfoques terapéuticos más extensivos y con mayor premura.
Dermatoscopio
Una herramienta clínica útil en la sospecha de CBC es el dermatoscopio, herramienta que permite, mediante un lente óptico, ampliar la imagen (10x). Esto permite visualizar de mejor manera la lesión e identificar estructuras anatómicas profundas que a simple vista no es posible ver. Mejora la sensibilidad a 95-97% y especificidad del 87-96% para el diagnóstico de CBC(31). Sin embargo, es importante destacar que es un método operador dependiente y debe ser personal entrenado y capacitado en la utilización de esta herramienta.
Biopsia
El diagnóstico definitivo se realiza por biopsia de la lesión y posterior estudio histopatológico. Los márgenes y tipo de cirugía van a depender de las características de la lesión y del paciente.(32)
CLASIFICACIÓN
La clasificación TNM, ampliamente utilizada para distintos tipos de neoplasia, es difícil de aplicar para este tipo de cáncer, dado que sus formas severas no evolucionan a metástasis a distancia y el tamaño no cobra gran relevancia. Por tanto, el enfrentamiento del manejo de un CBC va a depender del riesgo de recurrencia local, determinado por características propias de la lesión, así como del paciente. Los criterios que se toman en cuenta para definir alto y bajo riesgo son: localización, tamaño, definición de los bordes, presencia de recidiva (primario v/s recurrente), inmunosupresión, localización en un sitio que previamente recibió radioterapia, tipo histológico y presencia o no de invasión perineural(32).
Existe otra clasificación, propuesta por la Asociación Europea para Dermatooncología (EADO), quien junto a un grupo de expertos, observaron patrones y características clínicas para definir cinco grupos. El consenso se basa en tamaño, ubicación, compromiso de funcionalidad y busca determinar la facilidad/dificultad que va a implicar el tratamiento de cada lesión(33).
TRATAMIENTO
El objetivo primario del tratamiento de CBC es lograr la resección completa del tumor con la mayor preservación posible de la función y cosmesis. Debe ser individualizado a las características propias de la lesión de cada paciente, considerando tamaño, profundidad, localización. En este sentido, si bien lo más efectivo y eficiente es la resección quirúrgica, existen ocasiones en las cuales podría optarse por otros tipos de tratamiento, como radioterapia, terapia tópica o sistémica(32).

1. Resección quirúrgica
El tratamiento curativo de elección frente a una CBC es la cirugía. Se busca la resección completa de la lesión, con márgenes adecuados para asegurar no dejar remanente tumoral, disminuyendo el riesgo de recidiva. Se recomienda típicamente en CBC primarios, ubicados en tronco, extremidades superiores e inferiores. Se describe una tasa de recurrencia de entre 0.8 a 17.4%, variando según se trate de lesiones de bajo o alto riesgo.
Los márgenes recomendados varían según las características de la lesión y existen distintas recomendaciones. La organización americana National Comprehensive Cancer Network (NCCN) actualmente recomienda en aquellos catalogados como de bajo riesgo, se obtenga un margen clínico de 4 mm, mientras que, en aquellos de alto riesgo, se debe intentar obtener un margen mayor (idealmente sobre los 6 mm, aunque dada la variabilidad de características que pueden definirlo como de alto riesgo, la guía no recomienda algún margen definido y sugiere evaluar caso a caso). Se debe realizar control de márgenes durante la cirugía para intentar asegurar la obtención de márgenes negativos(32).
2. Cirugía micrográfica
La cirugía micrográfica o cirugía de Mohs es una técnica quirúrgica desarrollada por el Dr. Frederick Mohs en los años 1930, ampliamente difundida en la actualidad y utilizada para diferentes neoplasias cutáneas. Es un método que ofrece altas tasas de curación y baja tasa de recurrencia, siendo el gold standard para el manejo de este tipo de neoplasias. Se ha visto una tasa de recurrencia a 5 años del 1% para CBC primarios y 5.6% para CBC recidivante, correspondiendo a la menor tasa comparado con las otras opciones de tratamiento(34,35).
La técnica quirúrgica consiste en resecciones de la lesión tumoral con márgenes pequeños, con el fin de preservar la mayor cantidad posible de tejido sano. En el intraoperatorio, se espera del anatomopatólogo, mediante una metodología especial, el análisis del 100% de los márgenes periféricos y profundos de la muestra obtenida (comparado con metodología tradicional, donde se analizan sólo algunos segmentos de la muestra). Según compromiso de algún borde, se amplía en el mismo tiempo quirúrgico dicho borde de forma dirigida, hasta obtener márgenes libres de tumor. Es un procedimiento que demanda un mayor tiempo quirúrgico, requiere de personal entrenado en la técnica y coordinación con equipo de anatomía patológica.
Es el método de elección cuando la lesión es de alto riesgo de recurrencia, o bien, cuando se localiza en zonas en que la preservación de la mayor cantidad de tejido es vital, como lo son región facial, párpados, nariz, labios, región periauricular, genitales, manos, pezones(36). Además, también se utiliza como método para ampliar márgenes cuando tras una resección quirúrgica, se obtienen márgenes positivos en la biopsia diferida.
Terapias tópicas
En pacientes con CBC tipo superficial, puede considerarse el manejo con terapias tópicas, tales como imiquimod, 5-fluoracilo o fototerapia dinámica; sin embargo, la tasa de curación utilizando estas modalidades de tratamiento son hasta 10% menores comparados con las modalidades quirúrgicas(37).
a. Imiquimod: tratamiento tópico, aprobado por la Food and Drug Administration (FDA) y la Agencia Europea de Medicamentos (EMA), con demostrada actividad antitumoral y antiviral mediada por interferón alfa. Es un modulador de la respuesta inmune, mediante agonismo del receptor similar a Toll 7(38). Estudios randomizados de fase III han demostrado que paciente con CBC superficial o nodular tienen un 82.5% de éxito de tratamiento, con mejores resultados cosméticos; sin embargo, la tasa de curación sigue siendo significativamente mayor utilizando la escisión quirúrgica(39).
b. 5-Fluoracilo: análogo de la pirimidina, actúa como antineoplásico al interferir en la síntesis de ADN(40). Se ha utilizado en el tratamiento de la queratosis actínica y del CBC. Se aplica de forma tópica en la lesión por un periodo variable, de entre 4 a 6 semanas. Si bien ha sido poco estudiado, se han reportado tasas de curación de hasta 90%, destacando la adecuada tolerancia por parte de los pacientes y los buenos resultados estéticos(41).
c. Terapia fotodinámica (TFD): medicamento fotosensibilizador que al tener contacto con luz UV genera especies de oxígeno activadas, gatillando respuesta inmunológica antitumoral y llevando a la destrucción de las células cancerígenas(42). Ha demostrado ser una terapia efectiva, con tasas de curación que varían entre el 60 al 100% según distintos estudios. Si bien presenta mejores resultados estéticos que el tratamiento quirúrgico, este último sigue siendo superior en tasas de curación y recurrencia. Es una terapia nueva y aún hay escasa evidencia sobre su efectividad a largo plazo(32,43).
d. Crioterapia: tratamiento local, en el cual mediante la aplicación de temperatura menor a 0°C y utilizando nitrógeno líquido, se logra la destrucción del tejido. Es una técnica utilizada hace muchos años, con tasas de recurrencia que van entre 0 a 13%. Tiene la desventaja de no otorgar una muestra de tejido para estudio histopatológico, fundamental para la confirmación diagnóstica y clasificación. Además, presenta pobres resultados estéticos y bajo nivel de satisfacción por parte de los pacientes, por lo que su uso se limita a otro tipo de lesiones de la piel(32).
e. Inhibidores de la vía Hedgehog: los inhibidores de la vía Hedgehog tópicos están siendo estudiados como alternativa en el tratamiento del CBC, especialmente en casos en donde la cirugía no es viable. Uno de los ensayos clínicos más avanzados corresponde al Patidegib, mostrando hasta el momento resultados favorables, con tasas de efectos adversos mínimas(43).
Respecto a la utilidad y elección de algún tratamiento superficial, un estudio randomizado controlado multicéntrico reciente comparó la eficacia de estas distintas modalidades de tratamiento, utilizando pacientes con CBC superficial. En conclusión, el estudio interpreta que el imiquimod fue la modalidad de tratamiento con mejores resultados, mientras que la FTD fue el con peor resultados(44). Ahora bien, es importante destacar que, si bien son modalidades de tratamiento efectivas y en muchos casos útiles, en la práctica clínica se reservan para pacientes de alto riesgo quirúrgico. Siempre que sea posible, el tratamiento quirúrgico sigue siendo de primera elección.
3. Radioterapia
La radioterapia (RT) es una herramienta que también es útil para el manejo del CBC. Tiene distintas utilidades: CBC primarios cuando por funcionalidad/preferencia del paciente se descarta la opción de manejo quirúrgico, tumores irresecables (por localización y/o extensión) o en pacientes inoperables (contraindicación médica) o para continuar el manejo cuando los márgenes postquirúrgicos son positivos y no es posible ampliar quirúrgicamente, o la morbilidad de ello sería considerable(32). Es especialmente útil cuando, tras la resección de la lesión, la biopsia informa invasión perineural(45).
Comparado con la resección quirúrgica, la utilización de RT como manejo primario ha demostrado mayor tasa de recurrencia, peores resultados cosméticos y mayor complicaciones locales(46).
4. Terapias sistémicas
Existen opciones de tratamiento sistémico para el manejo de CBC; sin embargo, no son de primera línea y se reservan para casos específicos
a. Inhibidores de la vía Hedgehog (vismodegib y sonidegib): Se han desarrollado fármacos que actúan a nivel de la vía Hedgehog, vía de señalización estrictamente relacionada con el crecimiento celular y proliferación de células neoplásicas en el CBC. Actualmente existen dos medicamentos aprobados por la FDA: el vismodegib y en sonidegib. Sus resultados hasta el momento no han demostrado efectividad superior a las otras modalidades de tratamiento descritas y tiene la desventaja de que las células neoplásicas pueden generar resistencia. Su uso aún está en desarrollo y se propone como terapia en pacientes con múltiples CBC o CBC inducidos por RT que están fuera de alcance quirúrgico(32,47).
b. Inhibidores de PD-1 (nivolumab y pembrolizumab): son fármacos que han surgido como opción terapéutica en CBC avanzado, sobre todo en aquellos casos que no responden de forma adecuada a los inhibidores de la vía Hedgehog. Su mecanismo de acción es bloquear la interacción entre PD-1 y su ligando PD-L1, evitando que se bloquee la respuesta inmune, lo que permite potenciar la respuesta contra las células tumorales(48). Un estudio de fase 2 demostró que el Nivolumab puede inducir respuestas completas en el 12.5% de los casos y, parciales en el 18.8%. Poseen un perfil de seguridad adecuado y si bien sus efectos adversos son manejables, pueden diferir de las clásicas observadas en inmunoterapia(49).
c. Quimioterapia: dado que la tasa de metástasis del CBC es sumamente baja, el uso de QMT es sumamente limitado y hay escasa evidencia en la literatura al respecto.
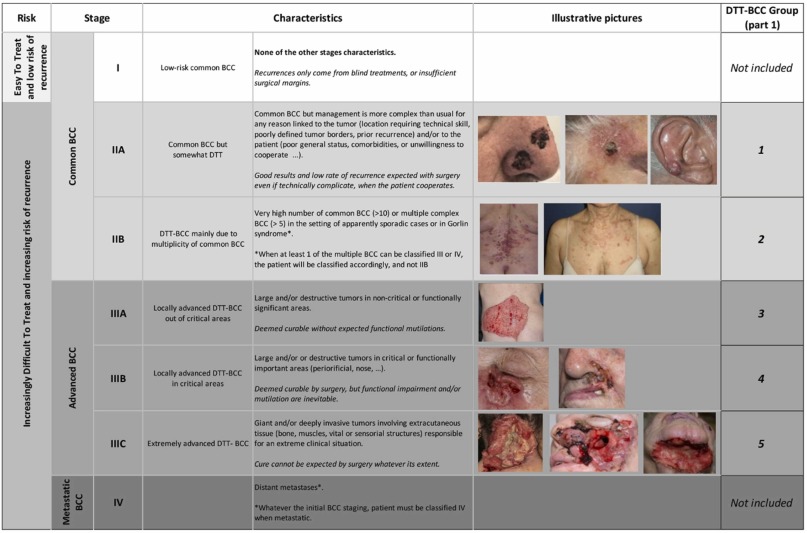
Tabla obtenida de Position statement on clasification of basal cell carcinomas. Part 2: EADO proposal for New operacional staging system adapted to basal cell carcinomas(33)
SEGUIMIENTO
Pacientes que en algún minuto desarrollaron un CBC deben ser seguidos de por vida, pues se ha estimado que entre 30 a 50% de estos pacientes desarrollan un nuevo CBC a lo largo de su vida, lo que representa un riesgo 10 veces mayor comparado con la población general(50).
Se recomienda cada 6 a 12 meses evaluación médica con examen físico completo en búsqueda de cambios en las lesiones o aparición de una nueva. Junto al seguimiento clínico, es imprescindible una correcta educación al paciente sobre medidas de fotoprotección y autoexamen físico.
CONCLUSIÓN
El CBC es una neoplasia sumamente frecuente con factores de riesgo claramente dilucidados, por lo que la prevención es fundamental. Se debe evitar la fotoexposición desde edades tempranas, con énfasis en medidas de fotoprotección. Por otra parte, es importante educar a la población sobre la importancia del autoexamen físico y características de la lesión ante las cuales deben consultar. De esta forma, podremos obtener un diagnóstico precoz, instaurar tratamiento lo antes posible y evitar una morbilidad mayor.
Ante la sospecha clínica, se debe confirmar diagnóstico con biopsia. El riesgo de recidiva de la lesión viene dado por características clínicas de la lesión, así como histopatología. Según eso, las guías recomiendan distintos márgenes clínicos al momento de realizar la escisión quirúrgica.
El tratamiento de elección es la cirugía micrográfica o de Mohs, procedimiento que permite resecar la lesión, logrando resguardar la mayor cantidad de tejido sano posible. Ahora bien, es un procedimiento que requiere personal capacitado y demanda mayor tiempo quirúrgico.
Existen otras metodologías de tratamiento, tanto locales como sistémicas, que se reservan para casos particulares, generalmente para pacientes en quienes la cirugía no está recomendada. Además, hay otras medidas terapéuticas que están en investigación y cuyo avance podría traer cambios en el manejo de estas lesiones.
REFERENCIAS
1. Gandhi SA, & Kampp J. Skin cancer epidemiology, detection and management. The Medical Clinics of North America 2015;99:1323–35.
2. Guy GP, Machlin SR, Ekwueme DU, Yabroff KR. Prevalence and costs of skin cancer treatment in the U.S., 2002-2006 and 2007-2011. American Journal of Preventive Medicine 2015;48:183–7.
3. Goldsmith L, Katz S, Barbara A, Paller A, Leffell D, Wolff K. Carcinoma basocelular Fitzpatrick. Dermatología en Medicina General 2014;8:1293-301.
4. Fecher L. Systemic therapy for inoperable and metastatic basal cell cáncer. Current Treatment Options in Oncology 2013;14:237-48.
5. Wadhera A, Fazio M, Bricca G, Stanton O. Metastatic basal cell carcinoma: a case report and literature review. How accurate is our incidence data? Dermatol Online J 2006;12:7.
6. Rogers HW, Weinstock MA, Feldman SR, Coldiron BM. Incidence estimate of nonmelanoma skin cancer (keratinocyte carcinomas) in the U.S. Population, 2012. JAMA Dermatol 2015;151:1081-6.
7. Ibrahim Nader, Matthew Jovic, Stephen Ali, Namor Williams, John A G Gibson, Rowena Griffiths et al. The epidemiology, healthcare and societal burden of basal cell carcinoma in Wales 2000-2018: a retrospective nationwide analysis. The British Journal Of Dermatology 2023;188:380-9.
8. Wu P, Stern R, Robinson J, Corona R. Epidemiology, pathogenesis and clinical features of basal cell carcinoma. UptoDate Julio; 2019.
9. Alter M, Hillen U, Leiter U, Sachse M, Gutzmer R. Current diagnosis and treatment of basal cell carcinoma. J Dtsch Dermatol Ges 2015;13:863-74.
10. Gallardo V, Ruiz M, Parera A, Hernandez A. Solar radiation: types and effects. ARS Pharmaceutica 2000;41:167-76.
11. Vitasa BC, Taylor HR, Strickland PT, Rosenthal FS, West S, Abbey H et al. Association of nonmelanoma skin cancer and actinic keratosis with cumulative solar ultraviolet exposure in Maryland watermen. Cancer 1990;65:2811-7.
12. Gallagher RP, Hill GB, Bajdik CD, Fincham S, Coldman AJ, McLean DI et al. Sunlight exposure, pigmentary factors, and risk of nonmelanocytic skin cancer. I. Basal cell carcinoma. Arch Dermatol 1995;131:157-63.
13. Hannuksela-Svahn A, Pukkala E, Karvonen J. Basal cell skin carcinoma and other nonmelanoma skin cancers in Finland from 1956 through 1995. Arch Dermatol 1999;135:781-6.
14. Marks R, Staples M, Giles GG. Trends in non-melanocytic skin cancer treated in Australia: the second national survey. Int J Cancer 1993;53:585-90.
15. Levi F, Moeckli R, Randimbison L, Te VC, Maspoli M, La Vecchia C. Skin cancer in survivors of childhood and adolescent cancer. Eur J Cancer 2006;42:656-9.
16. Gudbjartsson DF, Sulem P, Stacey SN, Goldstein AM, Rafnar T, Sigurgeirsson B et al. ASIP and TYR pigmentation variants associate with cutaneous melanoma and basal cell carcinoma. Nat Genet 2008;40:886-91.
17. Han J, Kraft P, Colditz GA, Wong J, Hunter DJ. Melanocortin 1 receptor variants and skin cancer risk. Int J Cancer 2006;119:1976-84.
18. Euvrard S, Kanitakis J, Claudy A. Skin cancers after organ transplantation. N Engl J Med 2003;348:1681-91.
19. Silverberg MJ, Leyden W, Warton EM, Quesenberry CP Jr, Engels EA, Asgari MM. HIV infection status, immunodeficiency, and the incidence of non-melanoma skin cancer. J Natl Cancer Inst 2013;105:350-60.
20. Khalesi M, Whiteman DC, Tran B, Kimlin MG, Olsen CM, Neale RE. A meta-analysis of pigmentary characteristics, sun sensitivity, freckling and melanocytic nevi and risk of basal cell carcinoma of the skin. Cancer Epidemiol 2013;37:534-43.
21. Robinson JK. Risk of developing another basal cell carcinoma. A 5-year prospective study. Cancer 1987;60:118-20.
22. Karagas MR, Stukel TA, Greenberg ER, Baron JA, Mott LA, Stern RS. Risk of subsequent basal cell carcinoma and squamous cell carcinoma of the skin among patients with prior skin cancer. Skin Cancer Prevention Study Group. JAMA 1992;267:3305-10.
23. Wehner MR, Linos E, Parvataneni R, Stuart SE, Boscardin WJ, Chren MM. Timing of subsequent new tumors in patients who present with basal cell carcinoma or cutaneous squamous cell carcinoma. JAMA Dermatol 2015;151:382-8.
24. Mayer JE, Goldman RH. Arsenic and skin cancer in the USA: the current evidence regarding arsenic-contaminated drinking water. Int J Dermatol 2016;55:e585-e591.
25. Scrivener Y, Grosshans E, Cribier B. Variations of basal cell carcinomas according to gender, age, location and histopathological subtype. Br J Dermatol 2002;147:41-7.
26. NCCN Clinical Practice Guidelines in Oncology. Basal Cell Skin Cancer. Versión 1. 2025.
27. Peggy A. Basal cell carcinoma: Epidemiology, pathogenesis, clinical features, and diagnosis. UptoDate. Enero; 2024.
28. Goldsmith L, Katz S, Barbara A, Paller A, Leffell D, Wolff K. Carcinoma basocelular Fitzpatrick. Dermatología en Medicina General 2014;8:1293-301.
29. Urrego-Rivera FL, Faura-Berruga C. Diagnóstico diferencial del carcinoma basocelular pigmentado. Revista Clínica de Medicina de Familia 2015;8:166-70.
30. Murgia G, Denaro N, Boggio F, Nazzaro G, Bortoluzzi P, Passoni E et al. Basosquamous carcinoma: comprehensive clinical and histowww. pathological aspects, novel imaging tools and therapeutic approaches. Cells 2023;12:2737.
31. Villarreal A, Ocampo J. Técnicas actuales para el diagnóstico del carcinoma basocelular: dermatoscopía y microscopía de reflectancia confocal. Dermatol Rev Mex 2015;59:129-35.
32. NCCN Clinical Practice Guidelines in Oncology. Basal Cell Skin Cancer. Versión 1. 2025.
33. Grob JJ, C Gaudy-Marqueste, A Guminski, J Malvehy, N Basset-Seguin, B Bertrand et al. Position statement on classification of basal cell carcinomas. Part 2: EADO proposal for new operational staging system adapted to basal cell carcinomas. Journal of the European Academy of Dermatology and Venereology 2021;11:2149-53.
34. Rowe DE, Carroll RJ, Day CL Jr. Longterm recurrence rates in previously untreated (primary) basal cell carcinoma: implications for patient follow-up. J Dermatol Surg Oncol 1989;15:315-28.
35. Rowe DE, Carroll RJ, Day CL Jr. Mohs surgery is the treatment of choice for recurrent (previously treated) basal cell carcinoma. J Dermatol Surg Oncol 1989;15:424-31.
36. Prickett A, Ramsey M. Mohs Micrographic Surgery. StatPearls. Julio; 2023.
37. Jansen MHE, Mosterd K, Arits AHMM, Roozeboom MH, Sommer A, Essers BAB et al. Five-Year results of a randomized controlled trial comparing effectiveness of photodynamic therapy, topical imiquimod, and topical 5-fluorouracil in patients with superficial basal cell carcinoma. J Invest Dermatol 2018;138:527-33.
38. Carneiro RC, de Macedo EM, Matayoshi S. Imiquimod 5% cream for the treatment of periocular basal cell carcinoma. Ophthalmic Plast Reconstr Surg 2010;26:100-2.
39. Bath-Hextall F, Ozolins M, Armstrong SJ, Colver GB, Perkins W, Miller PS et al. Surgery versus Imiquimod for Nodular Superficial basal cell carcinoma (SINS) study group. Surgical excision versus imiquimod 5% cream for nodular and superficial basalcell carcinoma (SINS): a multicentre, noninferiority, randomised controlled trial. Lancet Oncol 2014;15:96-105.
40. Cumbreño S, Pérez F. Fluorouracilo 5% pomada. Elsevier 2006;25:131-3.
41. Gross K, Kircik L, Kricorian G. 5% 5-Fluorouracil cream for the treatment of small superficial Basal cell carcinoma: efficacy, tolerability, cosmetic outcome, and patient satisfaction. Dermatol Surg 2007;33:433-9.
42. Ariza S, Espinosa S, Naranjo M. Terapias no quirúrgicas para el carcinoma basocelular: revisión. Actas Dermo-Sifiliográficas 2017;108:809-17.
43. Lear JT, Harwood CA, Hasan Z, Kentley J, Thomson J, Khoo A et al. Phase 2 trial of topical application of the hedgehog inhibitor patidegib in patients with Gorlin syndrome. Br J Dermatol 2024 Nov 15:ljae444.
44. Arits AH, Mosterd K, Essers BA, Spoorenberg E, Sommer A, De Rooij MJ et al. Photodynamic therapy versus topical imiquimod versus topical fluorouracil for treatment of superficial basal-cell carcinoma: a single blind, non-inferiority, randomised controlled trial. Lancet Oncol 2013;14:647- 54.
45. Mendenhall WM, Ferlito A, Takes RP, Bradford CR, Corry J, Fagan JJ et al. Cutaneous head and neck basal and squamous cell carcinomas with perineural invasion. Oral Oncol 2012;48:918-22.
46. Avril MF, Auperin A, Margulis A, Gerbaulet A, Duvillard P, Benhamou E et al. Basal cell carcinoma of the face: surgery or radiotherapy? 214 Revista Hospital Clínico Universidad de Chile Results of a randomized study. Br J Cancer 1997;76:100-6.
47. Stratigos AJ, Sekulic A, Peris K, Bechter O, Prey S, Kaatz M et al. Cemiplimab in locally advanced basal cell carcinoma after hedgehog inhibitor therapy: an open-label, multi-centre, single-arm, phase 2 trial. Lancet Oncol 2021;22:848-57.
48. Nikanjam M, P R Cohen, S Kato, J K Sicklick, R Kurzrock. Advanced basal cell cancer: concise review of molecular characteristics and novel targeted and immune therapeutics. Annals of Oncology 2018;29:2192-9.
49. In Gino Kim Aparna Nallagangula, Jacob Seung Choi, Lisa Tachiki, Matthew J Blackburn, Stephen Capone et al. Clinical activity of PD-1 inhibition in the treatment of locally advanced or metastatic basal cell carcinoma. Journal for Inmunotherapy of Cancer 2022;10:5.
50. Marie Véron, Sylvie Chevret, Jean-Jacques Grob, Marie Beylot-Barry, Philippe Saiag, Aude Fléchon et al. Safety and efficacy of nivolumab, an anti-PD1 immunotherapy, in patients with advanced basal cell carcinoma, after failure or intolerance to sonic Hedgehog inhibitors: UNICANCER AcSé NIVOLUMAB trial. European Journal of Cancer (Oxford, England) 1990;177:103-11.
51. Marcil I, Stern RS. Risk of developing a subsequent nonmelanoma skin cancer in patients with a history of nonmelanoma skin cancer: a critical review of the literature and metaanalysis. Arch Dermatol 2000;136:1524-30.
Correspondencia:
 Dr. Daniel Rappoport Wurgaft
Dr. Daniel Rappoport Wurgaft
 Unidad Cirugía Cabeza y Cuello, Departamento de Cirugía, HCUCH
Unidad Cirugía Cabeza y Cuello, Departamento de Cirugía, HCUCH
 [email protected]
[email protected]
 569 9236 0724
569 9236 0724