Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Tromboprofilaxis en pacientes médicos hospitalizados. ¿A todos por igual?
Venous thromboembolic disease is the leading preventable cause of hospital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors ase is the leading preventable cause of hospital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors for deep venous thrombosis crucial to provide a correct prevention. This article reviewed the indications, contraindications and complications of thromboprophylaxis. Difficult cases in elderly, obese, chronic kidney disease, critical care and cirrhotic patients were reviewed. The purpose of this article is to support decision – making on dvt prevention in hospitalized medical patients.
Venous thromboembolic disease is the leading preventable cause of hos spital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors for deep venous thrombosis crucial to provide a correct prevention. This article reviewed the indications, contraindications and complications of thromboprophylaxis. Difficult cases in elderly, obese, chronic kidney disease, critical care and cirrhotic patients were reviewed. The purpose of this article is to support decision – making on dvt prevention in hospitalized medical patients.
Venous thromboembolic disease is the leading preventable cause of hos spital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors for deep venous thrombosis crucial to provide a correct prevention. This article reviewed the indications, contraindications and complications of thromboprophylaxis. Difficult cases in elderly, obese, chronic kidney disease, critical care and cirrhotic patients were reviewed. The purpose of this article is to support decision – making on dvt prevention in hospitalized medical patients.
Venous thromboembolic disease is the leading preventable cause of hos spital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors for deep venous thrombosis crucial to provide a correct prevention. This article reviewed the indications, contraindications and complications of thromboprophylaxis. Difficult cases in elderly, obese, chronic kidney disease, critical care and cirrhotic patients
were reviewed. The purpose of this article is to support decision – making on dvt prevention
in hospitalized medical patients.
Venous thromboembolic disease is the leading preventable cause of hos spital mortality. Up to 75% of these are in non - surgical patients. This is a large, heterogeneous group of patients; so to know the risk factors for deep venous thrombosis crucial to provide a correct prevention. This article reviewed the indications, contraindications and complications of thromboprophylaxis. Difficult cases in elderly, obese, chronic kidney disease, critical care and cirrhotic patients
were reviewed. The purpose of this article is to support decision – making on dvt prevention
in hospitalized medical patients.
Rev Hosp Clin Univ Chile 2015; 26(3): 185-97.
Raimundo Gazitúa P., Silvana Saavedra G., Guillermo Conte L., Gastón Figueroa M.
La enfermedad tromboembólica (ETE), cuya presentación clínica está constituida por la trombosis venosa profunda (TVP) y el tromboembolismo pulmonar (TEP), es una de las principales complicaciones prevenibles en pacientes hospitalizados y es responsable de hasta un 10% de la mortalidad intrahospitalaria(1,2).
Aunque clásicamente se ha tenido especial consideración en relación a pacientes quirúrgicos, un 50-70% de los eventos tromboembólicos y hasta el 80% de los TEP fatales ocurren en pacientes médicos(3), siendo éste un grupo heterogéneo y con múltiples factores de riesgo tales como insuficiencia cardíaca congestiva, insuficiencia respiratoria, reposo prolongado, ETE previa, accidentes vasculares con déficit motor de extremidades inferiores, sepsis, enfermedad inflamatoria intestinal, cáncer activo, edad avanzada, paciente crítico y uso de catéter venoso central(3,4).
Diversos estudios han demostrado que la profilaxis farmacológica con heparinas es segura y eficaz, disminuyendo el riesgo de ETE y mortalidad por TEP(5). Pese a ello la utilización de tromboprofilaxis es baja, tal como lo demostró el estudio multicéntrico ENDORSE, donde sólo el 39,5% de pacientes médicos recibieron profilaxis, pese a tener criterios de indicación(6).
El propósito de este artículo de revisión es servir de apoyo en la toma de decisiones relacionadas a la prevención de ETE en pacientes médicos hospitalizados.
MATERIALES Y MÉTODOS
La presentación de la evidencia del presente artículo corresponden a la información obtenida a partir de guías de práctica clínica, tomando como punto de referencia la 8ª y 9ª Guía para Prevención de ETE del Colegio Americano de Médicos del Tórax. (ACCP). Además se revisaron las publicaciones que los autores de este trabajo -tres hematólogos y un médico internista- consideraron relevantes en base a un análisis crítico de la literatura. Se incluyeron revisiones sistemáticas, metaanálisis, ensayos clínicos y estudios observacionales entre 1989 al año 2014.
Este artículo consta de dos partes, la primera revisa factores de riesgo, indicaciones, contraindicaciones, objetivos, complicaciones y los distintos métodos de tromboprofilaxis. La segunda parte, analiza el uso de tromboprofilaxis en los siguientes grupos especiales: adultos mayores, obesos, enfermedad renal crónica avanzada, paciente crítico y daño hepático crónico.
Se determinó la selección de estos grupos debido a su importante prevalencia en los servicios de medicina interna en los cuales la utilización de tromboprofilaxis farmacológica genera áreas de incertidumbre. Se analizaron exclusivamente pacientes médicos debido a la baja cobertura de tromboprofilaxis a nivel hospitalario tal como se observa en estudios multicéntricos(6).
ESTRATIFICACIÓN DE RIESGOS DE ETE EN PACIENTES MÉDICOS
La hospitalización por una enfermedad médica se asocia a un incremento de 8 veces para desarrollar ETE(7). Estudios prospectivos mostraron en pacientes sin profilaxis una incidencia de TVP de 2-4,9% por ecografía y una incidencia de TEP de 0,3-1.5% de los casos(8-10). Desafortunadamente, los pacientes médicos constituyen un grupo heterogéneo, con uno o más factores de riesgo para ETE. En la literatura se describe que el 75-80% de los pacientes médicos hospitalizados poseen al menos un factor de riesgo y hasta el 40 % de ellos tiene tres o más en forma simultánea(3) (Tabla 1).
Tabla 1. Factores de riesgo para enfermedad tromboembólica
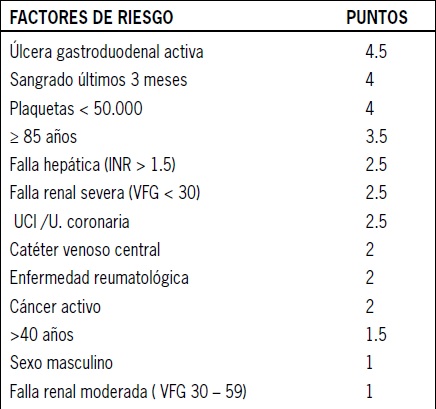
Existen 2 formas de estratificar el riesgo de paciente para determinar la indicación de tromboprofilaxis. El primero considera el riesgo individual de cada paciente basado en sus factores de riesgo. En un estudio prospectivo, 1.180 pacientes fueron estratificados siguiendo el score de Padua (Tabla 2), que asigna puntaje a 11 factores de riesgo y categoriza a los pacientes en bajo riesgo (menor que 4 puntos) o alto riesgo (≥4 puntos). Con un seguimiento a 90 días, se observó ETE en 11.0% de pacientes de alto riesgo sin profilaxis (TVP 6.7%, TEP no fatal 3.9% y TEP fatal 0.4%) versus 0.3% de los pacientes de bajo riesgo (HR, 32.0; 95% CI, 4.1-251.0)(11) A pesar de que se evaluó un bajo número de pacientes y se excluyeron pacientes con clearance menor que 30 ml/min, este modelo constituye herramienta útil para categorizar riesgo de ETE(7).
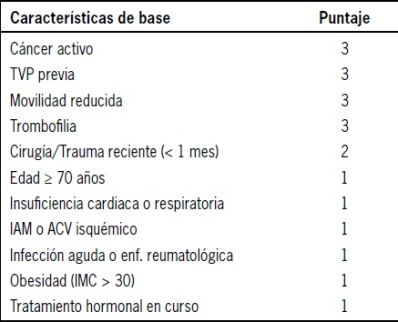
Tabla 2. Score predictivo de padua para enfermedad tromboembólica
La segunda forma involucra la implementación de tromboprofilaxis a todos los pacientes médicos que tengan reposo y posean algún factor de riesgo adicional para ETE(3).
DETERMINACIÓN DEL RIESGO DE SANGRADO
Tal como se ha establecido el riesgo de presentar ETE, es importante identificar quiénes tienen mayor probabilidad de sangrado asociado al uso de anticoagulación profiláctica. A partir de un registro de más de 15.000 pacientes, se identificaron factores de riesgo asociados a hemorragia y se elaboró un sistema de calificación, verificando que los pacientes con ≥7 puntos presentaron mayor riesgo hemorrágico. Los pacientes con un puntaje menor a 7 tuvieron una incidencia de sangrado mayor y sangrado no mayor clínicamente relevante de 0,4% y 1,5% respectivamente a diferencia de los que exhibieron un puntaje ≥7 quienes mostraron una incidencia de 4,1% y 7%(12) (Tabla 3).
Tabla 3. Score IMPROVE. Riesgo de sangrado

OBJETIVOS DE LA TROMBOPROFILAXIS
La tromboprofilaxis tiene como objetivos prevenir la aparición de eventos tromboembólicos, evitar las secuelas a largo plazo, tales como la recurrencia de TVP, síndrome postrombótico e hipertensión pulmonar y reducir la mortalidad relacionada a la ETE(7).
INDICACIONES DE TROMBOPROFILAXIS
Nuestro grupo de trabajo ha definido como indicación de tromboprofilaxis a los pacientes médicos hospitalizados que presentan un puntaje en el score de Padua ≥ 4 o en pacientes con una estadía presunta ≥ a 4 días y que presenten factores de riesgos asociados a la ETE como lo son la insuficiencia cardiaca crónica descompensada, insuficiencia respiratoria aguda o crónica reagudizada, edad mayor a 40 años, sepsis, cáncer activo, enfermedad neurológica aguda con déficit motor de extremidades inferiores y trombosis venosa previa entre otros factores de riesgo que han demostrado una incidencia mayor de ETE en pacientes hospitalizados (Tabla 4).
Tabla 4. Indicaciones de tromboprofilaxis

CONTRAINDICACIONES DE TROMBOPROFILAXIS FARMACOLÓGICA
Las contraindicaciones de tromboprofilaxis farmacológica son condiciones en las cuales predomina el riesgo de hemorragia asociado a la administración profiláctica de heparinas por sobre el beneficio potencial de evitar un evento tromboembólico. Las contraindicaciones para tromboprofilaxis farmacológica son un puntaje en el score improve >7 puntos, hemorragia activa, coagulopatías, trombocitopenia y úlcera péptica activa entre otras. En estos casos se recomienda exclusivamente el uso de tromboprofilaxis mecánica como se detalla en el siguiente párrafo (Tabla 5).
Tabla 5. Contraindicaciones de tromboprofilaxis

MÉTODOS DE TROMBOPROFILAXIS
1. Movilización precoz de los pacientes: incluye movilización activa y pasiva de los pacientes, incluyendo la deambulación precoz.
2. Métodos mecánicos: consiste en el uso de medias elásticas de compresión gradual y dispositivos de compresión neumática intermitente. La efectividad en disminución de ETE se ha demostrado solamente en pacientes quirúrgicos; sin embargo, esto no se ha logrado replicar en pacientes médicos. De la misma forma, no existe evidencia que avale su uso en forma simultánea con profilaxis farmacológica. Estos métodos se recomiendan cuando existe contraindicación para tromboprofilaxis farmacológica (grado 1A) y con menor nivel de evidencia se sugieren en asociación con anticoagulantes (grado 2A)(3).
3. Métodos farmacológicos: consisten en la administración por vía subcutánea de heparinas no fraccionadas (HNF), heparinas de bajo peso molecular (HBPM) y pentasacáridos como fondaparinux (3,7-10). Un metaanálisis publicado en 2007 evaluó el uso de profilaxis farmacológica, incluyendo 9 estudios y cerca de 20.000 pacientes, mostrando una reducción del riesgo relativo (RRR) para TEP fatal (64%), TEP (58%) y TVP (53%) sin mayor riesgo de sangrado(5).
Aunque la utilización de HNF 5000 u.i dos veces diarias es más segura en cuanto a menor incidencia de eventos hemorrágicos, la utilización HNF 5000 u.i. tres veces al día es más eficaz en la prevención de ETE(13) Respecto al uso de HBPM, se evaluó profilaxis contra placebo en los estudios MEDENOX(9) (enoxaparina 40 mg sc/día) y PREVENT(10) dalteparina (5000 U sc/día), mostrando una RRR para TVP de 63 y 45% respectivamente. Al comparar HBPM y HNF, un metaanálisis reciente determinó que la utilización de HBPM es superior a HNF respecto a reducción de ETE y menor incidencia de sangrado(14). En cuanto a los pentasacaridos, el estudio ARTEMIS evaluó el uso de fondaparinux (2.5 mg sc/día) contra placebo, demostrando una reducción significativa de TVP y TEP fatal sin diferencias respecto a la incidencia de sangrado mayor(5). Respecto a los nuevos anticoagulantes rivaroxaban y apixaban, los estudios MAGELLAN y ADOPT evidenciaron un mayor riesgo de sangrado sin demostrar superioridad sobre HBPM en la prevencion de ETE(15,16).
Para prevención de ETE en pacientes médicos hospitalizados, las guías actuales recomiendan la utilización de HBPM (enoxaparina 40 mg/día sc, dalteparina 5000 u sc/ día), HNF (5000 u.i 2 o 3 veces al día) o fondaparinux (2,5 mg sc al día)(7) .
DURACIÓN DE TROMBOPROFILAXIS
Actualmente no existe evidencia que establezca la duración exacta de tromboprofilaxis en pacientes médicos. A nuestro criterio, estará determinada por la persistencia de la condición que motivó la indicación. Para el caso de un factor de riesgo irreversible o indefinido, la tromboprofilaxis se mantendrá durante toda la hospitalización. En casos particulares de alto riesgo trombótico quedará a criterio del clínico considerar la tromboprofilaxis extendida más allá de la hospitalización. Las guías vigentes no recomiendan extender la tromboprofilaxis más allá de lo que dura la inmovilidad o la hospitalización(7). La figura 1 muestra el esquema propuesto por nuestro equipo de trabajo de tromboprofilaxis a pacientes médicos hospitalizados.
Figura 1. Indicaciones de tromboprofilaxis
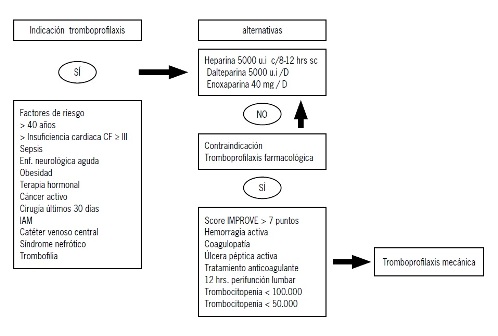
COMPLICACIONES
Los principales eventos adversos de la tromboprofilaxis farmacológica incluyen la hemorragia y la trombocitopenia inducida por heparina (TIH). Respecto a la hemorragia, se ha demostrado que la tasa de sangrado mayor no difiere de placebo en la mayoría de los ensayos con enoxaparina, dalteparina y fundaparinux (0.2-1.7%)(8-10). En relación a la incidencia de TIH, ésta oscila entre 1- 3% y 0-0,8% para HNF y HBPM respectivamente, pudiendo alcanzar una mortalidad cercana al 30%(17). Para fundaparinux, la asociación con TIH es excepcional, describiéndose sólo un caso en la literatura(18) .
POBLACIONES ESPECIALES
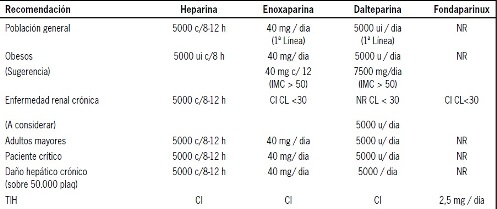
La Tabla 6 resume las recomendaciones de tromboprofilaxis farmacológica en la población general y poblaciones especiales de pacientes médicos.
Tabla 6. Recomendaciones profilaxis farmacológica enfermedad tromboembólica
Los AM tienen un riesgo elevado de presentar ETE. Además de la edad como factor de riesgo individual, en los AM concurren múltiples comorbilidades tanto crónicas (insuficiencia cardiaca, insuficiencia respiratoria, inmovilidad) y agudas (fracturas, ACV) que determinan un mayor riesgo adicional. Del mismo modo, el riesgo de hemorragia incrementa acorde a la edad, estimándose un riesgo de 3,4 y 0,8% para hemorragia severa y letal en mayores de 80 años. Preocupación respecto a un mayor riesgo de sangrado, interacciones farmacológicas y riesgo de caídas dan cuenta que la tromboprofilaxis esté subutilizada en este grupo, alcanzando niveles cercanos al 40%. Análisis post-hoc de los estudios MEDENOX y PREVENT en pacientes >75 años mostraron una RRR de 78% y 48% para TVP en pacientes médicos sin asociar mayor riesgo de sangrado(19). Mahe et al monitorizó niveles anti-Xa en 68 AM que recibieron profilaxis con enoxaparina 40 mg sc/día. Al segundo día de estudio, la mitad de la población evaluada presentó niveles en rango terapéutico y un 69%, al 8º día(20). La tromboprofilaxis en los AM hospitalizados está indicada ante la presencia de otro FR de riesgo para ETE. La recomendación no difiere de la población general, pudiendo utilizar HNF o HBPM a dosis profilácticas. En caso de contraindicación, se recomienda el uso de métodos mecánicos.
Obesos
La obesidad es un factor de riesgo independiente para ETE; sin embargo, en este grupo la información referente a tromboprofilaxis proviene mayoritariamente de pacientes quirúrgicos. En análisis de subgrupos de los estudios MEDENOX (20% obesos) y PREVENT (30% obesos), se vio que la profilaxis con enoxaparina y dalteparina fue igualmente eficaz con RR de 0,49 y 0,64 respectivamente(9-10).
Un estudio de cohorte confirmó que los obesos tienen mayor riesgo de ETE con un hazard ratio (HR) de 2.10 para índice de masa corporal (IMC) >35 versus IMC menro que 20 (95% IC, 1.39-3.16;p=0.001)(21). En una serie de 481 pacientes sometidos a cirugía bariátrica (mediana IMC = 50), la ocurrencia de TVP fue significativamente menor al aumentar la dosis de enoxaparina (40 mg diarios v/s 30 mg c/12 horas), registrándose un episodio hemorrágico por cada grupo(22). Recientemente en un estudio de cohorte retrospectivo que incluyó cerca de 4.000 pacientes médicos y quirúrgicos se analizó el uso de dosis mayores de tromboprofilaxis versus dosis estándar (HNF 7500 u.i c/8 o enoxaparina 40 mg c/12 hrs versus HNF 5000 c/8-12 hrs o enoxaparina 40 mg c/24 hrs), evidenciando que la incidencia de ETE se redujo a la mitad (1.48 vs 0.77 OR 0.5 P = 0.05) sin aumento del riesgo de sangrado(23).
Enfermedad renal crónica (ERC)
Los pacientes con ERC históricamente han sido considerados de bajo riesgo tromboembólico debido a la disfunción plaquetaria asociada; sin embargo, estudios epidemiológicos han reportado mayor riesgo de ETE en pacientes en etapa 3-4(24) y hemodiálisis(25). Esto podría explicarse por la mayor asociación a factores de riesgo para ETE tales como inmovilidad, accesos vasculares e insuficiencia cardiaca, y a nivel molecular, por un déficit funcional de proteína C activada, aumento de PAI -1 e hiperhomocisteinemia(24,25). El riñón constituye la principal vía de metabolización de las HBPM, por lo que pacientes con falla renal presentan una mayor bioacumulación. Un metaanálisis que analizó HBPM a dosis terapéuticas y profilácticas evidenció una tasa de hemorragia de 5% en pacientes con clearance menor que 30 ml/min y 2.4% con clearance >30 ml/min (OR de 2.25: IC 95% 1.19-4.27, p=0.013). Para enoxaparina a dosis terapéutica ajustada por función renal no hubo diferencias respecto a sangrado. En cuanto a HBPM a dosis profilácticas no se demostró bioacumulación(26).
En otro estudio pacientes con enfermedad renal con clearence menor que 30 ml/min, al utilizar enoxaparina a dosis profiláctica, se observó una depuración 39% inferior respecto a individuos con función renal normal(27). Respecto a dalteparina profiláctica en pacientes nefrópatas, incluyendo clearance bajo 30 ml/min, no se encontró acumulación mayor a 30% con seguimiento a 10 días(28). En pacientes con ERC con clearence > 30 ml/min las recomendaciones de profilaxis farmacológica no difieren de la población general; sin embargo, en pacientes con clearence menor que 30 ml/min, existe evidencia de bioacumulación para enoxaparina(27).
Pacientes críticos
La ETE es una complicación importante en el paciente crítico, con una incidencia cercana al 20-40% sin tromboprofilaxis y hasta 10% en pacientes con HNF durante la estadía en UCI(29). Estos pacientes presentan mayor riesgo de ETE debido a inmovilidad, cirugía reciente, trauma, estado inflamatorio y uso de catéteres entre otros. Se ha demostrado eficacia tanto en el uso de HNF y HBPM versus placebo en la prevención de ETE(3,7).
La tromboprofilaxis mecánica en paciente crítico está recomendada en pacientes con contraindicaciones para la profilaxis farmacológica. No se ha demostrado beneficio adicional al asociarlas en conjunto(30).
En un estudio de 156 pacientes críticos con falla renal (clearence menor que 30 ml /min) con dalteparina 5000 ui sc/día no demostró bioacumulación hasta 17 días de seguimiento. Una posible explicación es el mayor peso molecular de dalteparina que determina una mayor depuración extrarrenal respecto a otras HBPM(29). En ese mismo estudio la incidencia de TVP proximal (5%) fue consistente con los valores reportados en otros ensayos. La incidencia de sangrado mayor fue de 7%; tasa también comparable. Se identificaron como factores de riesgo de hemorragia el uso de aspirina, INR elevado y mayor puntaje APACHE II(31). En pacientes críticos también se comparó de forma prospectiva tromboprofilaxis con dalteparina 5000 u sc/dia versus HNF 5000 usc /12. Los resultados mostraron que dalteparina no difiere a HNF en la aparición de TVP proximal; sin embargo, demostró tener menor incidencia en TEP y TIH sin diferencias en la tasa de sangrado mayor(32). En cuanto a enoxaparina, en otro estudio se evaluaron prospectivamente 89 pacientes recibiendo dosis profiláctica con medición de anti-Xa a las 4 horas, logrando rango profiláctico en el 56% de los casos, con valores marcadamente menores en los pacientes con falla orgánica múltiple y sobrepeso(22).
En otra muestra de pacientes críticos en que se también se utilizó enoxaparina 40 mg, se demostraron valores significativamente menores de anti-Xa comparado con hospitalizados no críticos(33).
La tromboprofilaxis farmacológica en el paciente crítico está ampliamente recomendada. Las guías clínicas vigentes recomiendan el uso de HBPM o HNF, y utilización de profilaxis mecánica en pacientes con alto riesgo de sangrado(7). Por otra parte, es importante recalcar que la biodisponibilidad de las distintas HBPM en estos pacientes se ven con frecuencia alteradas, detectando en muchos ensayos niveles menores de antiXa(22,33). Aún no queda establecido el correlato clínico que estos niveles bajos de AntiXa puedan tener en la incidencia de ETE para este grupo.
Daño hepático crónico (DHC)
Clásicamente se ha descrito la disminución de factores de la coagulación y trombocitopenia de los pacientes con DHC como protectora de eventos tromboembólicos; sin embargo, en diferentes estudios poblacionales la incidencia de TVP/TEP varía entre 0.5-6.3%(34), rango similar a pacientes control, lo que derriba el concepto errado de “auto-anticoagulación”. La patogénesis de ETE en pacientes cirróticos es multifactorial, incluyendo factores locales propios de la hipertensión portal y sistémicos, como la disminución de síntesis de factores anticoagulantes como antitrombina y proteína C junto con elevación de citoquinas proinflamatorias, factor VIII y factor von Willebrand(34,38). Respecto al rol que juega la etiología del DHC sobre el riesgo trombótico no se han demostrado diferencias significativas(35);sin embargo, pacientes con enfermedades hepáticas autoinmunes y enfermedades colestásicas presentan una mayor tasa de trombosis portal(36,37). Se ha observado una asociación independiente entre el grado de hipoalbuminemia y la probabilidad de desarrollar un evento trombótico(35) . En un reciente metaanálisis se evidenció que el uso de tromboprofilaxis farmacológica es seguro en pacientes cirróticos y no aumenta los eventos hemorrágicos, pero tampoco demostró disminución de eventos tromboembólicos (38);sin embargo, en otra cohorte retrospectiva de pacientes portadores de DHC al estratificar por score predictivo de Padua, los pacientes cirróticos de riesgo trombótico alto (>4 puntos) presentaron una mayor incidencia de ETE y al recibir tromboprofilaxis farmacológica disminuyeron la incidencia de ETE en un 50%(39). Por lo tanto, la profilaxis de ETE debe ser considerada en pacientes cirróticos siempre cuando presenten factores de riesgo, considerando métodos mecánicos si existe alto riesgo de sangrado.
DISCUSIÓN
En este artículo de revisión nuestro grupo propone revisar la importancia de la tromboprofilaxis en pacientes médicos hospitalizados, ya que constituye la principal causa de muerte prevenible en pacientes hospitalizados. A pesar de existir más de 25 guías de prevención de ETE, la tromboprofilaxis continúa siendo insuficiente, como lo demuestra el estudio multinacional ENDORSE(6). Nuestra revisión, al igual que otros artículos nacionales(40) y guías de práctica clínica vigentes(3,7), señala los factores de riesgo, indicaciones, contraindicaciones y finalmente propone un algoritmo de tromboprofilaxis, el cual es utilizado en el Departamento de Medicina Interna de nuestro Hospital. Ya que los pacientes médicos hospitalizados constituyen un grupo heterogéneo, estimamos necesario revisar en detalle los grupos especiales en que la utilización de tromboprofilaxis genera controversia. En pacientes obesos la dosis recomendada por las guías actuales no difieren de la población general; sin embargo, existe creciente evidencia para obesos mórbidos (IMC > 40) en los cuales es posible utilizar de manera segura dosis mayores de tromboprofilaxis: dalteparina 7500 u sc/día o enoxaparina 0,5 mg/kg c/12. Respecto al riesgo de bioacumulación de HBPM, es importante el análisis del grupo de AM y nefrópatas. En los AM hospitalizados, la evidencia demuestra que se benefician del uso de tromboprofilaxis farmacológica, disminuyendo la incidencia de ETE y aunque estudios farmacocinéticos determinaron mayor bioacumulación de HBPM por medición de Anti X activado, esto no se asoció a una mayor incidencia de sangrado relacionada a la tromboprofilaxis. Por lo tanto, la tromboprofilaxis farmacológica en AM hospitalizados está indicada ante la presencia de factores de riesgo de ETE. En el grupo de nefrópatas la recomendación sobre clearence >30 ml/ min no difiere de la población general, pero en la población de ERC con depuración menor a 30 ml/min es HNF (5000 U sc c/ 8 – 12 hrs); sin embargo, también podría considerar el uso de dalterapina 5000 U sc/ día por periodos acotados, ya que no existe evidencia de bioacumulación a dosis profiláctica(28). En los grupos donde coexiste un elevado riesgo de ETE y sangrado como el caso de pacientes críticos y DHC, es importante el análisis caso a caso de ambos aspectos. Para ambos grupos la indicación es similar a la población general; sin embargo, el análisis de ambos aspectos en cada paciente individual es fundamental, lo cual es posible utilizando modelos prospectivos para riesgo de ETE (score de Padua) y retrospectivos para riesgo de sangrado (score IMPROVE). Si bien existen otros grupos 194 Revista Hospital Clínico Universidad de Chile especiales de interés, como son los pacientes sépticos, oncológicos o portadores de hipercoagulabilidad primaria, no profundizamos mayormente debido a que la indicación de profilaxis no difiere respecto a la población general con factores de riesgo para ETE.
CONCLUSIONES
La ETE es la principal causa de mortalidad hospitalaria evitable, por lo cual es necesario establecer políticas locales orientadas a promover su prevención que incluyan protocolos locales, algoritmos impresos y electrónicos disponibles en ficha clínica electrónica y su difusión académica, insertándola en los contenidos de la formación de pregrado y postgrado. Además es fundamental conocer la realidad local respecto a tromboprofilaxis tanto en población general y grupos especiales para así poder focalizar de mejor forma la adherencia a futuras estrategias de tromboprofilaxis.
REFERENCIAS
1. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: are we detecting enough deep vein thrombosis? JR Soc Med 1989;82:203-5.
2. Baglin TP, White K, Charles A. Fatal pulmonary embolism in hospitalized medical patients. J Clin Pathol 1997;50:609-10.
3. Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM, Lassen MR et al. Prevention of venous thromboembolism: American College of Chest Physicians Evidence Based Clinical Practice Guidelines (8th Edition). Chest 2008;133(6 Suppl):381S-453S.
4. Pendleton R, Wheeler M, Rodgers G. Venous thromboembolism prevention in the acutely ill medical patient: a review of the literature and focus on special patient populations. Am J Hematol 2005,79:229–37.
5. Dentali F, Douketis JD, Gianni M, Lim W, Crowther MA. Meta-analysis: anticoagulant prophylaxis to prevent symptomatic venous thromboembolism in hospitalized medical patients. Ann Intern Med 2007;146:278-88.
6. Cohen AT, Tapson VF, Bergmann JF, Goldhaber SZ, Kakkar AK, Deslandes B et al. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational crosssectional study. Lancet 2008;371:387-94.
7. Kahn SR, Lim W, Dunn AS, Cushman, Dentali F, Akl A. Prevention of VTE in non surgical patients. Antithrombotic therapy and prevention of thrombosis. (9th edition). American college of chest physicians evidence
based clinical practice guidelines. Chest 2012;141;e195S- e226S.
8. Cohen AT, Davidson BL, Gallus AS, Lassen MR, Prins MH, Tomkowski W et al. Efficacy and safety of fondaparinux for the prevention of venous thromboembolism in older acute medical patients: randomized placebo controlled trial. BMJ 2006;332:325-9.
9. Samama MM, Cohen AT, Darmon J-Y, Desjardins L, Eldor A, Janbon C et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prophylaxis in medical patients with enoxaparin study group. N Engl J Med 1999;341:793-800.
10. Leizorovicz A, Cohen AT, Turpie AG, Olsson CG, Vaitkus PT, Goldhaber SZ. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004;110:874-9.
11. Barbar S, Noventa F, Rosseto V, Ferrari A, Brandolin B, Perlati M et al. A risk assesment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua prediction score. J Thromb Haemost 8:2450-7.
12. Decousus H, Tapson VF, Bergmann JF, Chong BH, Froehlich JB, Kakkar AK et al. Factors at admission associated with bleeding risk in medical patients. Chest 2011;139:69-79.
13. King CS, Holley AB, Jackson JL, Shorr AF, Moores LK. Twice vs three times daily heparin dosing for thromboembolism prophylaxis in the general medical population. A metaanalysis. Chest 2007;131:507-16.
14. Alikhan R, Bedenis R, Cohen AT. Heparin for the prevention of venous thromboembolism in acute ill medical patients (excluding stroke and myocardial infarction). Cochrane Datasable Syst Rev 2014;5.
15. Cohen AT, Spiro TE, Buller HR, Haskell Ll, Hu D, Hull R et al. Extended-duration rivaroxaban thromboprophylaxis in acutely ill medical patients: MAGELLAN. N Engl J Med 2013;368:513-23.
16. Goldhaber SZ, Leizorovicz A, Kakkar A, Haas S, Merli G, Knabb RM et al. Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients. N Engl J Med 2011;365:2167-77.
17. Shantsilla E, Lip GY, Chong BH. Heparininduced thrombocitopenia: a contemporary clinical approach to diagnosis and management. Chest 2009;135:1651-64.
18. Warketin TE, Maurer BT, Aster RH. Heparin induced thrombocytopenia associated with fondaparinux. N Engl J Med 2007;356:2653-5.
19. Lacut K, Le Gal G, Mottier D. Primary prevention of venous thromboembolism in eldery medical patients. Clin Interv Aging 2008;3:399-411.
20. Mahe I, Drouet L, Chassany O, Grenard AS, Caulin C, Bergmann JF. Low molecular weight heparin for the prevention of deep venous thrombosis: a suitable monitoring in elderly patients? Pathophysiol Haemost Thromb 2002;32:134–6.
21. Holst AG, Jensen G, Prescott E. Risk Factors for Venous thromboembolism Results from the copenhagen city heart study. Circulation 2010;121:1896-903.
22. Scholten DJ, Hoedema RM, Scholten SE. A Comparison of two different prophylactic dose regimens of low molecular weight heparin in bariatric surgery. Obes Surg 2002;12:19-24.
23. Wang TF, Milligan PE, Wong C, Deal E, Thoelke M, Gage BF. Efficacy and safety of high-dose thromboprophylaxis in morbidity obese inpatients. J Thromb Haemost 2014;111:88-93.
24. Wattanakit K, Cushman M, Stehman-Breen C, Heckbert SR, Folsom AR. Chronic kidney disease increases risk for venous thromboembolism. J Am Soc Nephrol 2008;19:135–40.
25. Tveit DP, Hypolite IO, Hshieh P, Cruess D, Agodoa LY, Welch PG et al. Chronic dialysis patients have high risk for pulmonary embolism. Am J Kidney Dis 2002;39:1011–7.
26. Lim W, Dentali F, Eikelboom JW, Crowther MA. Meta-analysis: low-molecular-weight heparin and bleeding in patients with severe renal insufficiency. Ann Intern Med 2006;144:673-84.
27. Sanderink GJ, Guimart CG, Ozoux ML, Jariwala NU, Shukla UA, Boutouyrie BX. Pharmacokinetics and pharmacodynamics of the prophylactic dose of enoxaparin once daily over 4 days in patients with renal impairment. Thromb Res 2002;105:225–31.
28. Schmid P, Brodmann D, Fischer AG, Wuillemin WA. Study of bioaccumulation of dalteparin at a prophylactic dose in patients with various degrees of impaired renal function. J Thromb Haemost 2009;7:552-8.
29. Douketis J, Cook D, Meade M, Guyatt G, Geerts W, Skrobik et al. Prophylaxis against deep vein thrombosis in critically ill patients with severe renal insufficiency with the lowmolecular-weight heparin dalteparin: an assessment of safety and pharmacodynamics: the DIRECT study. Arch Intern Med 2008;168:1805-12.
30. Limpus A, Chaboyer W, McDonald E, Thalib L. Mechanical thrombophylaxis in critically ill patients: a systematic review and metaanalysis. Am J Crit Care 2006;15:402-10.
31. Cook D, Douketis J, Meade M, Guyatt G, Zytaruk N, Granton J. Venous thromboembolism and bleeding in critically ill patients with severe renal insufficiency receiving dalteparin thromboprophylaxis: prevalence, incidence and risk factors. Crit Care 2008;12:R32.
32. Cook D, Meade M, Guyatt G, Walter S, Heels-Ansdell D, Warkentin TE et al. Dalteparin versus unfractionated heparin in critically ill patients. PROTECT Investigators for the Canadian Critical Care Trials Group and the Australian and New Zealand Intensive Care Society Clinical Trials Group. N Engl J Med 2011;364:1305-14.
33. Priglinger U, Karth GD, Geppert A, Joukhadar C, Graf S, Berger J et al. Prophylactic anticoagulation with enoxaparin: Is the subcutaneous route appropriate in the critically Ill? Crit Care Med 2003;31:1405-9.
34. Tripodi A, Mannucci PM. The coagulopathy of chronic liver disease. N Engl J Med 2011;365:147-56.
35. Northup PG, McMahon MM, Ruhl AP, Altschuler SE, Volk-Bednarz A, Caldwell SH et al. Coagulopathy does not fully protect hospitalized cirrhosis patients from peripheral venous thromboembolism. Am J Gastroenterol 2006;101:1524–8.
36. Webster GJ, Burroughs AK, Riordan SM. Review article: portal vein thrombosis - new insights into aetiology and management. Aliment Pharmacol Ther 2005;21:1–9.
37. Ben Ari Z, Panagou M, Patch D, Bates S, Osman E, Pasi J et al. Hypercoagulability in patients with primary biliary cirrhosis and primary sclerosing cholangitis evaluated by thrombelastography. J Hepatol 1997;6:554–9.
38. Gómez Cuervo C, Bisbal Pardo O, Pérez Jacoiste Asín MA. Efficacy and safety of the use of heparin as thromboprofylaxis in patients with liver cirrhosis: a systematic review and metaanalysis. Thrombosis Research 2013;132:414-9.
39. Bogari H, Patanwala, AE, Cosgrove R, Katz M. Risk assessment and pharmacological prophylaxis of venous thromboembolism in hospitalized patients with chronic liver disease. Thrombosis Research 2014;134:1220-3.
40. Aizman A, Abbott E, Rojas L. Profilaxis de enfermedad tromboembólica en pacientes hospitalizados con patología médica, estrechando la brecha entre las guías y la práctica clínica. Rev Med Chile 2011;139;1210-7.
Correspondencia:
 Dr. Raimundo Gazitúa Pepper
Dr. Raimundo Gazitúa Pepper
 Sección Hematología, HCUCH
Sección Hematología, HCUCH
 [email protected]
[email protected]
 562 2978 8420
562 2978 8420