Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Serie guías clínicas: complicaciones del embarazo gemelar monocorial
Rev Hosp Clin Univ Chile 2016; 27(4): 329-44
Álvaro Sepúlveda-Martínez, Enrique Valdés R., Mauro Parra-Cordero
El embarazo múltiple es una entidad que ha ido en aumento los últimos 20 a 30 años a causa del desarrollo progresivo de técnicas de fertilización asistida (TRA) y del aumento de la edad materna(2,3). Las TRA han logrado incrementos variables de embarazos múltiples, dependiendo del grado de complejidad de la técnica utilizada. El uso de inductores de ovulación ha demostrado aumentar en 20% los embarazos gemelares bicigotos(2), mientras que el uso de técnicas de alta complejidad como la fertilización in vitro (FIV) ha demostrado incrementar hasta 10 veces los embarazos gemelares(4-6) (tanto bi como monocigotos). Esto ha llevado a diversos países a plantear la transferencia de un embrión como un método de disminuir este problema.
La incidencia de embarazos gemelares varía en distintas zonas geográficas, con frecuencias de 1 de cada 80 a 100 embarazos (1%)(2,3,7); sin embargo, actualmente se describen tasas de hasta un 3%(5,8). Desde el punto de vista de la cigocidad, los gemelos bicigotos poseen una incidencia de 1%, mientras que los monocigotos poseen una incidencia constante de 3,5 x 1.000 nacimientos(9), siendo un tercio de este grupo monocoriales.
Las complicaciones asociadas a los gemelos monocoriales que se desarrollarán en la siguiente guía son las siguientes:
• Síndrome de transfusión feto-fetal (STFF): incidencia 1 – 3 x 100.000 RNV(10).
• Secuencia anemia policitemia (SAP): incidencia 3 a 5% de gemelos monocoriales (espontáneo), 2 a 13% post láser por STFF (iatrogénico)(11).
• Restricción de crecimiento fetal selectiva (RCFs): incidencia 11 a 14% de gemelos monocoriales(12).
• Secuencia perfusión arterial reversa (TRAP): incidencia 1 en 35.000 embarazos, 1% de gestaciones monocoriales(13).
• Muerte intrauterina del cogemelo: incidencia 12% de las gestaciones monocoriales(14).
OBJETIVOS DE LA GUÍA CLÍNICA
Conocer las complicaciones específicas de gestaciones monocoriales.
Reconocer las formas de presentación de la restricción selectiva.
Identificar los hallazgos ecográficos para clasificar la transfusión feto-fetal.
Comprender las eventuales complicaciones perinatales del gemelo sobreviviente en casos de cogemelo muerto. Conocer el manejo integral de las gestaciones monocoriales.
¿A QUIÉN VA DIRIGIDA LA PRESENTE GUÍA CLÍNICA?
La siguiente guía va dirigida a matronas, estudiantes de Medicina, becados/residentes de Ginecología y Obstetricia, becados/residentes de Medicina Materno-Fetal, obstetras que se desempeñan en hospitales de 3° nivel y especialistas en Medicina Materno-Fetal, con el fin de actualizar los conocimientos en el manejo de gestaciones monocoriales complicadas.
NIVEL DE EVIDENCIA (1)
1++: Metaanálisis de alta calidad, revisiones sistemáticas de estudios randomizados controlados (ERC) o ERC con riesgo muy bajo de sesgo.
1+: Metaanálisis bien diseñados, revisiones sistemáticas de ERC o ERC con riesgo bajo de sesgo.
1-: Metaanálisis, revisiones sistemáticas de ERC o ERC con alto riesgo de sesgo.
2++: Revisiones sistemáticas de estudios casocontrol o cohorte de alta calidad o estudios de caso-control o cohorte de alta calidad con riesgo muy bajo de factores confundentes o con alta probabilidad de que la relación sea causal.
2+: Caso-control o cohortes bien desarrollados con bajo riesgo de factores confundentes, y una probabilidad moderada de que la relación sea causal.
2-: Estudios caso-control o cohorte con alto riesgo de factores confundentes, y riesgo significativo de que la relación no sea causal.
3: Estudios no analíticos, por ejemplo, reporte de casos o serie de casos.
4: Opinión de expertos.
GRADO DE RECOMENDACIÓN (1)
A: Al menos un meta-análisis, revisión sistemática o ERC en categoría 1++, y directamente aplicable a la población objetivo, o
Una revisión sistemática de ERC o un nivel de evidencia consistente principalmente de estudios en categoría 1+ directamente aplicable a la población objetivo y demostrando consistencia global en los resultados.
B: Cantidad de evidencia que incluya estudios en categoría 2++ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 1++ o 1+.
C: Cantidad de evidencia que incluye estudios en categoría 2+ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados, o
Evidencia extrapolada de estudios en categoría 2++.
D: Evidencia nivel 3 o 4, o
Evidencia extrapolada de estudios 2+
DIAGNÓSTICO
¿Cómo se diagnostican las complicaciones asociadas a los embarazos monocoriales? (Figura 1)
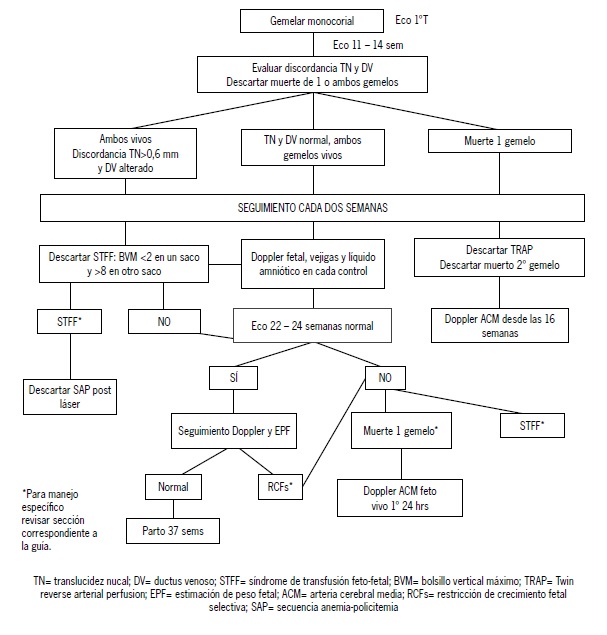
Figura 1. Enfoque integral de gestaciones monocoriales desde el primer trimestre de embarazo
TN= translucidez nucal; DV= ductus venoso; STFF= síndrome de transfusión feto-fetal; BVM= bolsillo vertical máximo; TRAP= Twin reverse arterial perfusion; EPF= estimación de peso fetal; ACM= arteria cerebral media; RCFs= restricción de crecimiento fetal selectiva; SAP= secuencia anemia-policitemia
STFF
Es una entidad de diagnóstico ecográfico antenatal que requiere la presencia de oligoamnios (BVM ≤ 2cms) y polihidramnios (BVM ≥ 8 cms) en el feto donante y receptor respectivamente, con disminución o ausencia de visualización de la vejiga del feto donante(15).
La clasificación actual se basa en los criterios descritos por Quintero et al [3](16,17), descritos en Tabla 2. Diversos autores han intentado incorporar a la práctica clínica nuevas clasificaciones, basándose fundamentalmente en la evaluación de la función miocárdica fetal [2+](18,19); sin embargo, aún no han logrado validarse por falta de estudios prospectivos.

Tabla 2. Clasificación del síndrome de transfusión feto-fetal según Quintero
Durante el primer trimestre se han podido identificar hallazgos sugerentes de STFF en el examen de rutina a las 11+0 – 13+6 semanas. Matias et al demostraron que la combinación de la presencia de ductus venoso anormal en alguno de los gemelos, combinado con una discordancia de la TN ≥ 0,6mm intergemelar se asocia a un riesgo relativo de STFF de 21 (IC 95% 5,47 – 98,33)(20) [3].
SAP
Discordancia severa en la concentración de hemoglobina fetal entre ambos fetos secundario a comunicaciones vasculares placentarias unidireccionales arterio-venosas en vasos de pequeño calibre, sin discordancia de líquido amniótico(15,21). El diagnóstico puede ser antenatal o postnatal (Tabla 3).

Tabla 3. Criterios diagnósticos de secuencia anemia-policitemia
Actualmente se recomienda una clasificación antenatal de SAP basada en los hallazgos ecográficos (Tabla 4).

Tabla 4. Clasificación antenatal de SAP (10)
RCFs
Se define como la presencia de un gemelo con un peso estimado inferior al percentil 10 según la curva de edad gestacional. La presencia de una discordancia >25% entre ambos gemelos puede observarse, pero no es necesaria para el diagnóstico. El grado de discordancia se determina con la fórmula: (A – B)*100 / A (siendo A el gemelo de mayor peso y B el gemelo de menor peso)(15).
La RCFs se clasifica según los hallazgos del Doppler en la arteria umbilical del feto afectado (Tabla 5).

Tabla 5. Clasificación de la RCF s según hallazgos del Doppler(22)
Secuencia TRAP
Corresponde a la situación extrema del STFF, caracterizándose por el flujo sanguíneo desde la arteria umbilical del gemelo bomba hacia la arteria umbilical del gemelo receptor (acárdico) en sentido retrógrado, secundario a comunicaciones arterio-arteriales, retornando la sangre al gemelo bomba por comunicaciones veno-venosas(15). El traspaso de sangre poco oxigenada al feto receptor trae como consecuencia la alteración del desarrollo de estructuras como cabeza, corazón y extremidades superiores.
Siempre considerar la posibilidad de desarrollo de TRAP posterior a la muerte de un gemelo durante el primer trimestre en gestaciones monocoriales.
MANEJO ANTENATAL
¿Existe evidencia actual relacionada al manejo antenatal de las distintas complicaciones de las gestaciones monocoriales?
• En STFF etapa I se recomienda la conducta expectante desde las 16 semanas. (Grado de recomendación C)
• En STFF etapas II a IV de menos de 26 semanas se recomienda el tratamiento con fotocoagulación láser en placenta. (Grado de recomendación A)
• En STFF etapa II sobre las 26 semanas se recomienda amniodrenaje, en etapa III se recomienda interrupción post corticoterapia (menor a 30 semanas), en etapa IV se recomienda interrupción al diagnóstico. (Grado de recomendación C)
• Se recomienda seguimiento periódico con Doppler de ACM en STFF tratado con fotocoagulación láser para descartar presencia de SAP. (Grado de recomendación D)
• Se recomienda la evaluación con ecocardiografía avanzada pre y post fotocoagulación láser en presencia de STFF para descartar presencia de estenosis/atresia pulmonar funcional en gemelo receptor. (Grado de recomendación D)
• En RCFs etapa I se recomienda control semanal con Doppler y conducta expectante. En etapa II y III se recomienda control semanal o bisemanal ante alteración venosa fetal. (Grado de recomendación C)
• En secuencia TRAP se recomienda coagulación bipolar de cordón de feto acárdico desde las 16 a 18 semanas. A edades gestacionales mayores se recomienda la coagulación bipolar de cordón o coagulación intrafetal. (Grado de recomendación D)
• En presencia de muerte de un gemelo en gestación monocorial, se recomienda la evaluación con Doppler de ACM dentro de las primeras 24 horas del diagnóstico. (Grado de recomendación D)
SEGUIMIENTO Y TRATAMIENTO
STFF
Una vez diagnosticado un STFF, el seguimiento dependerá de la etapa y la edad gestacional (Figura 2). No existen estudios randomizados que demuestren la periodicidad óptima de la evaluación ecográfica y Doppler. La Sociedad de Medicina Materno-Fetal americana recomienda control semanal con Doppler de ambos fetos y evaluación de líquido amniótico(24) [4]:
• Etapa I: actualmente se encuentra en curso un estudio randomizado en pacientes con STFF etapa I para determinar si la sobrevida posterior a la fotocoagulación láser es superior al manejo expectante (https://clinicaltrials.gov/ ct2/show/NCT01220011). Bebbington et al (25) [2+] y Rossi et al(26) [3] demostraron en estudios descriptivos que con conducta expectante en STFF etapa I, la progresión a etapas mayores es de un 15%, con una regresión o estabilidad de la etapa en el 85% restante. Con respecto a la utilidad de la fotocoagulación laser, un metaanálisis reciente no demostró beneficios en la sobrevida al compararlo con manejo expectante (sobrevida 75% vs 83% respectivamente)(27) [3]. Finalmente, un estudio basado en la opinión de expertos en diferentes países de América y europeos, demostró que la conducta expectante es la opción más preferida (78%), seguida por el amniodrenaje y laser (11% cada una) [4](28).
• Etapas II, III y IV: Senat et al randomizaron a 72 pacientes de menos de 26 semanas con STFF a fotocoagulación láser y 70 pacientes tratadas con amniodrenaje, demostrando que el láser se asoció a sobrevida significativamente mayor y menor morbilidad neurológica severa(29) [1-]. Existe evidencia reciente que la terapia láser, al igual que el amniodrenaje, podría ser efectiva en STFF diagnosticadas sobre las 26 semanas de gestación. Middeldorp et al en un análisis retrospectivo demostraron que la terapia láser sobre las 26 semanas se asoció a menos morbilidad neonatal severa que el amniodrenaje, pero con resultados semejantes de sobrevida(30) [2-]. Valsky et al a su vez compararon la sobrevida de fetos con STFF realizada entre las 26+0 y 28+6 semanas con aquellas realizadas antes de las 26 semanas, demostrando tasas de sobrevida semejantes(31) [2-]. Se necesitan estudios randomizados que apoyen la terapia láser sobre las 26 semanas.
• Etapa V: no existen estudios randomizados que evalúen el manejo de embarazos con STFF y muerte de un gemelo (ver manejo “Muerte intrauterina del cogemelo”).
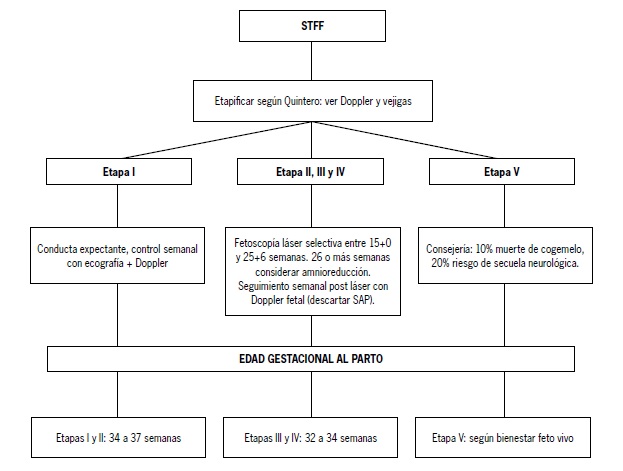
Figura 2. Manejo del síndrome de transfusión feto-fetal diagnosticado.
Evidencia reciente ha demostrado que gestaciones monocoriales tienen una tasa mayor de estenosis pulmonar antenatal, siendo el STFF el 98% de los casos, versus 2% en gestaciones monocoriales no complicadas(32) [3]. La evaluación con ecocardiografía fetal avanzada previo a la fotocoagulación láser ha demostrado que, dentro de los STFF, el gemelo receptor suele ser el frecuentemente afectado, observándose la presencia de estenosis/atresia pulmonar en el 10,8% de éstos(33).Posterior a la fotocoagulación láser, un tercio de los gemelos receptores afectados fallecieron, un tercio demostró una regresión de la estenosis en el período antenatal (estenosis funcional) y un tercio persistió hasta el período postnatal, requiriendo terapia correctora(33) [3].
SAP
Todo embarazo gemelar afectado por STFF que haya sido tratado con fotocoagulación láser, debe ser evaluado periódicamente con Doppler de ambos gemelos en busca de signos sugerentes de SAP(34) [4]; sin embargo, aún no hay consenso en la periodicidad. Hasta la fecha no existen estudios randomizados ni multicéntricos que evalúen el manejo ideal de SAP, siendo la evidencia limitada a reporte de casos o series de casos(34-37) [3].
El uso de transfusiones intravasculares (TIV) fetales en el feto anémico no ha demostrado mejorar el pronóstico, incluso asociándose a complicaciones en el gemelo poliglobúlico por transfusión excesiva de glóbulos rojos desde el feto anémico(38) [3] (Figura 3).

Figura 3. Manejo de la secuencia anemia-policitemia
La fetoscopía láser selectiva no ha demostrado efectividad, ya que las comunicaciones vasculares en SAP son de pequeño calibre, no siendo posible identificarlas al momento del procedimiento, asociado a la mayor dificultad técnica por la ausencia de discordancia en líquidos amnióticos. Un estudio randomizado reciente en cinco centros de referencia europeos comparó el uso de la técnica selectiva con la técnica Solomon (Solomon Trial), que consiste en una vez finalizada la coagulación selectiva, coagular la zona entre los puntos coagulados, abarcando todo el ecuador placentario. El uso de esta nueva técnica se asoció a una reducción de presencia de SAP post láser de 84% (16% vs 3%; OR 0,16 [0,05 – 0,49]) y reducción de reincidencia de STFF de 79% (7% vs 1%; OR 0,21 [0,04 – 0,98])(39).
RCFs
El manejo de la RCFs depende de la clasificación del feto afectado (Figura 4):
RCFs tipo I: debido al buen pronóstico, progresión infrecuente y a su nula a escasa secuela neurológica neonatal e infantil(12,40), el manejo expectante con seguimiento ecográfico semanal o bisemanal en busca de progresión al tipo II ha sido planteado como una buena estrategia [4](23). En caso de mantener Doppler normal, mantener embarazo hasta cercano al término.
RCFs tipo II: este grupo se asocia a un deterioro precoz intraútero en aproximadamente el 90% de los casos(40), con tasas elevadas de mortalidad tanto del feto afectado (29%) como del feto sano (22%)(12). Reporte de casos han demostrado que el deterioro precoz observado requiere frecuentemente interrupción a las 30 semanas(12,40); sin embargo, debido a las comunicaciones vasculares intergemelares, el deterioro es más lento que en embarazos únicos con Doppler umbilical reverso, siendo peor predictor de muerte fetal que el ductus venoso. Expertos consideran que ante DV normal, un seguimiento ecográfico semanal con Doppler es razonable y controles más estrictos si hay alteración venosa fetal(23) [4]. El manejo activo con fotocoagulación láser de las comunicaciones vasculares pudiera plantearse, asumiendo un riesgo elevado de mortalidad intrauterina del gemelo RCF (45% vs 41% en manejo expectante) debido a la pérdida de comunicaciones vasculares que compensan en parte su trastorno hemodinámico(41) [2-]. Chalouhi et al evaluaron recientemente a 45 pacientes con RCFs y demostraron que la ligadura del cordón del gemelo RCF ofrece las tasas más altas de sobrevida del gemelo normal en comparación con la fotocoagulación láser de la placenta (90,9% vs 74% res
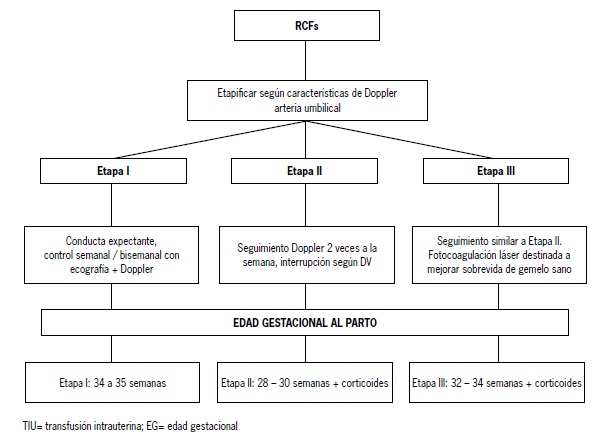
Figura 4. Manejo de la secuencia restricción fetal selectiva
RCF tipo III: el manejo puede ser expectante o activo. No existen estudios randomizados que establezcan la mejor terapia en RCFs con flujo reverso intermitente umbilical. Opinión de expertos plantean que el manejo expectante debe ser similar al tipo II, con seguimientos ecográficos con Doppler semanal si Doppler venoso es normal o seguimientos más frecuentes con alteraciones venosas iniciales [4](23). El manejo activo con mejores resultados de sobrevida del gemelo sano es la coagulación del cordón del gemelo RCF. La fotocoagulación láser se asocia con tasas muy elevadas de mortalidad del feto afectado (75%) durante la primera semana post procedimiento, pero con reducción significativa de mortalidad del gemelo sano [3](43).
Secuencia TRAP
No existe evidencia tipo I que establezca la periodicidad de los controles ecográficos en gemelos TRAP para disminuir la tasa de mortalidad del gemelo bomba. El diagnóstico de TRAP durante el primer trimestre ha demostrado tasas de mortalidad de 33% del gemelo bomba en el intervalo diagnóstico-fetoscopía(44) [3]. Diversos estudios de series de casos han establecido que el mejor momento para realizar la oclusión vascular del feto acárdico es la semana 16 a 18. Las opciones terapéuticas descritas son la oclusión vascular del cordón (ablación láser, coagulación monopolar o bipolar y embolización) y la coagulación intrafetal (instilación de alcohol, coagulación láser o bipolar). Una revisión de 74 casos comparó ambas técnicas, demostrando que la coagulación intrafetal se asocia con edades gestacionales al parto mayores, tasas menores de rotura de membranas y menores tasas de fracaso(45) [3]. Caso clínico local demostró la utilidad de la técnica intrafetal a las 26 semanas(46). Un estudio reciente no demostró diferencias significativas de sobrevida entre ablación con alcohol intra fetal o coagulación del cordón (60% y 50% respectivamente), siendo consideradas ambas técnicas como alternativas válidas(47) [3]. La propuesta de manejo se observa en la Figura 5.
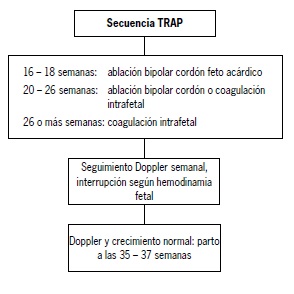
Figura 5. Manejo de la secuencia TRAP
Muerte intrauterina del cogemelo
Una revisión sistemática de seguimiento prospectivo de casos demostró que la muerte de un gemelo monocorial posterior al primer trimestre se asocia a un 12% de mortalidad del segundo gemelo, 18% de secuela neurológica y 68% de prematuridad(14). Hasta la fecha no existen estudios prospectivos randomizados que evalúen el mejor manejo del feto sobreviviente en caso de muerte de un gemelo monocorial. Senat et al evaluaron a 20 gemelos con STFF, con Doppler de ACM dentro de las 24 horas de la muerte de un gemelo, identificando 10 casos con anemia fetal severa que requirieron transfusión intrauterina (TIU)(48) [3]. Seguimiento a un año de vida en una serie de casos de STFF con muerte de un gemelo y con TIU dentro de las 24 horas siguientes, ha demostrado un desarrollo neurológico normal en 66,7% de los casos (4/6)(49) [3]. La TIU se plantea como una alternativa válida en gestaciones monocoriales con STFF y muerte de un gemelo con alteración del Doppler de ACM dentro de las 24 horas de la muerte(50,51) [3].
MANEJO DEL PARTO
¿Cuál es el momento más indicado para el parto en las gestaciones gemelares monocoriales complicadas?
• En STFF etapas I y II se recomienda el parto entre las 34 y 35 semanas. En etapas III y IV sobre las 26 semanas se recomienda interrupción según condiciones de neonatología, previo uso de corticoides. (Grado de recomendación D)
• En STFF etapa II sobre las 26 semanas se recomienda uso de amniodrenaje seriado hasta las 34 semanas. (Grado de recomendación D)
• En STFF con tratamiento láser exitoso se recomienda interrupción a las 34 – 35 semanas. (Grado de recomendación D)
• En gemelos con SAP post láser diagnosticado antes de las 30 semanas, se recomienda fotocoagulación láser no selectiva o TIU de gemelo anémico. Sobre las 30 semanas se recomienda interrupción del embarazo. (Grado de recomendación D)
• En RCFs etapa I se recomienda interrupción no antes de las 34 – 35 semanas. Etapa II se recomienda interrumpir al menos a las 28 semanas con corticoides previo. En RCFs etapa III se recomienda interrupción a las 32 semanas. (Grado de recomendación D)
• No existe consenso en el momento de interrupción en gemelos con secuencia TRAP. Deberá considerarse según el bienestar del gemelo bomba. (Grado de recomendación D)
STFF
No existen estudios randomizados ni consensos que definan el mejor momento del parto en embarazos afectados por STFF. Un comité de expertos recomienda que en Etapas I y II, con seguimiento periódico normal, el mejor momento del parto debe ser entre las 34 y 37 semanas. En Etapas III y IV sin otra complicación asociada el parto debiera ser entre las 32 y 34 semanas previo uso de corticoides(24) [4].
SAP
No existen estudios randomizados ni consensos que definan el mejor momento del parto en embarazos afectados por SAP. Basados en reportes de casos, algunos grupos proponen el manejo según la edad gestacional al diagnóstico. En embarazos afectados menores a 30 semanas se recomienda realizar TIU al gemelo anémico con el fin de aumentar la edad gestacional (no más de dos TIU por el riesgo de poliglobulia del gemelo receptor), en gestaciones de más de 30 semanas se sugiere la administración de corticoides y su posterior interrupción(15) [4].
RCFs
No existen estudios randomizados ni consensos que definan el mejor momento del parto en embarazos afectados por RCFs. Evidencia en estudios de casos ha demostrado que la evolución de gemelos con RCFs etapa I con control ecográfico estricto permite una interrupción electiva alrededor de las 34 – 35 semanas(23). En RCFs etapa II el momento de la interrupción va a ser dependiente del deterioro del DV. Opinión de expertos plantean la interrupción si es diagnosticado después de las 28 semanas, previo uso de corticoides(23). En RCFs etapa III expertos plantean la interrupción a las 32 – 34 semanas(23) [4].
Secuencia TRAP
No existen estudios randomizados ni consensos que definan el mejor momento del parto en embarazos afectados por TRAP. El momento de interrupción sólo ha sido descrito en reporte de casos, fluctuando entre las 31 y 36 semanas a causa de deterioro hemodinámico del feto bomba(13,52,53) [3]; sin embargo, si no hay deterioro del gemelo bomba, el embarazo puede evolucionar hasta el término.
Muerte intrauterina del cogemelo
No existen estudios randomizados ni consensos que definan el mejor momento del parto en embarazos afectados por la muerte de uno de los gemelos. Se ha demostrado en serie de casos que la edad gestacional al parto del gemelo sobreviviente fluctúa entre las 28 y las 40 semanas, siendo determinante en la decisión de la interrupción, el compromiso hemodinámico fetal(54) [3].
REFERENCIAS
1. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001;323:334–6.
2. Nicolaides K, Falcón O. La Ecografía de las 11 – 11+6 semanas (versión español). Fetal Medicine Foundation, Londres 2004; Capítulo 4:99-116
3. Endres L, Wilkins I. Epidemiology and Biology of Multiple Gestations. Clin Perinatol 2005;32:301-10.
4. Barrett J. Delivery of the term twin. Best Pracrice & Research Clinical Obstetrics and Gynaecology 2004;18:625-30.
5. Elliott J. Management og High-Order Multiple Gestation. Clin Perinatol 2005;32:387- 402.
6. Alhamdan D, Bora S, Condous G. Diagnosing twins in early pregnancy. Best Pract Res Clin Obstet Gynaecol 2009;23:453–61.
7. Sepúlveda W, Dezerega V, Valle P, Gutiérrez J, Carstens E, Sánchez J. Determinación prenatal de la corionicidad en el embarazo gemelar. Rev Chil Ultrasonog 1999;2:28-33.
8. Gyamfi C, Stone J, Eddleman K. Maternal complications of multifetal pregnancy. Clin Perinatol 2005;32:431–42.
9. Hasbún J. Capítulo 17: Complicaciones del embarazo gemelar. Ultrasonografía y Obstetricia Temas Selectos. Ediciones Journal 2007:297–316.
10. Blickstein I. Monochorionicity in perspective. Ultrasound Obstet Gynecol 2006;27:235–8.
11. Slaghekke F, Kist WJ, Oepkes D, Pasman SA, Middeldorp JM, Klumper FJ et al. Twin anemia-polycythemia sequence: diagnostic criteria, classification, perinatal management and outcome. Fetal Diagn Ther 2010;27:181–90.
12. Ishii K, Murakoshi T, Takahashi Y, Shinno T, Matsushita M, Naruse H et al. Perinatal outcome of monochorionic twins with selective intrauterine growth restriction and different types of umbilical artery Doppler under expectant management. Fetal Diagn Ther 2009;26:157–61.
13. Hartge D, Weichert J. Prenatal diagnosis and outcome of multiple pregnancies with reversed arterial perfusion (TRAP-sequence). Arch Gynecol Obstet 2012;286:81–8.
14. Ong S, Zamora J, Khan K, Kilbyc M. Prognosis for the co-twin following single-twin death: a systematic review. BJOG 2006;113:992–8.
15. Lewi L, Deprest J, Hecher K. The vascular anastomoses in monochorionic twin pregnancies and their clinical consequences. Am J Obstet Gynecol 2013;208:19–30.
16. Quintero RA, Morales WJ, Allen MH, Bornick PW, Johnson PK, Kruger M. Staging of twin-twin transfusion syndrome. J Perinatol 1999;19(8 Pt 1):550–5.
17. Quintero RA, Dickinson JE, Morales WJ, Bornick PW, Bermúdez C, Cincotta R et al. Stage-based treatment of twin-twin transfusion syndrome. Am J Obstet Gynecol 2003;188:1333–40.
18. Michelfelder E, Gottliebson W, Border W, Kinsel M, Polzin W, Livingston J et al. Early manifestations and spectrum of recipient twin cardiomyopathy in twin-twin transfusion syndrome: relation to Quintero stage. Ultrasound Obstet Gynecol 2007;30:965–71.
19. Rychik J, Tian Z, Bebbington M, Xu F, Mc- Cann M, Mann S et al. The twin-twin transfusion syndrome: spectrum of cardiovascular abnormality and development of a cardiovascular score to assess severity of disease. Am J Obstet Gynecol 2007;197:392.e1–392.e8.
20. Matias A, Montenegro N, Loureiro T, Cunha M, Duarte S, Freitas D et al. Screening for twin–twin transfusion syndrome at 11–14 weeks of pregnancy: the key role of ductus venosus blood flow assessment. Ultrasound Obstet Gynecol 2010;35:142–8.
21. Lopriore E, Middeldorp JM, Oepkes D, Kanhai HH, Walther FJ, Vandenbussche FP. Twin anemia-polycythemia sequence in two monochorionic twin pairs without oligo-polyhydramnios sequence. Placenta 2007;28:47–51.
22. Lewi L, Jani J, Blickstein I, Huber A, Gucciardo L, Van Mieghem T et al. The outcome of monochorionic diamniotic twin gestations in the era of invasive fetal therapy: a prospective cohort study. Am J Obstet Gynecol 2008;199:514–8.
23. Valsky D, Eixarch E, Martinez JM, Crispi F, Gratacós E. Selective intrauterine growth restriction in monochorionic twins: pathophysiology, diagnostic approach and management dilemmas. Semin Fetal Neonatal Med 2010;15:342–8.
24. SMFM Clinical Guideline. Twin-twin transfusion syndrome. Am J Obstet Gynecol 2013;208:3–18.
25. Bebbington MW, Tiblad E, Huesler-Charles M, Wilson RD, Mann SE, Johnson MP. Outcomes in a cohort of patients with stage I twin to-twin transfusion syndrome. Ultrasound Obstet Gynecol 2010;36:48–51.
26. Rossi C, D’Addario V. Survival outcomes of twin-twin transfusion syndrome in stage I: a systematic review of the literature. Am J Perinatol 2013;30:5–10.
27. Rossi AC, D’Addario V. The efficacy of Quintero staging system to assess severity of twin-twin transfusion syndrome treated with laser therapy: a systematic review with metaanalysis. Am J Perinatol 2009;26:537–44.
28. Molina S, Papanna R, Moise Jr K, Johnson A. Management of Stage I twin-to-twin transfusion syndrome: an international survey. Ultrasound Obstet Gynecol 2010;36:42–7.
29. Senat M, Deprest J, Boulvain M, Paupe A, Winer N, Ville Y. Endoscopic Laser Surgery versus Serial Amnioreduction for Severe Twin-to-Twin Transfusion Syndrome. N Engl J Med 2004;351:136–44.
30. Middeldorp J, Lopriore E, Sueters M, Klumper F, Kanhai H, Vandenbussche F et al. Twinto- twin transfusion syndrome after 26 weeks of gestation: is there a role for fetoscopic laser surgery? BJOG 2007;114:694–8.
31. Valsky DV, Eixarch E, Martinez-Crespo JM, Acosta ER, Lewi L, Deprest J et al. Fetosc opic laser surgery for twin-to-twin transfusion syndrome after 26 weeks of gestation. Fetal Diagn Ther 2012;31:30–4.
32. Stagnati V, Chalouhi GE, Essaoui M, Giuseppi A, Stirnemann JJ, Le Bidois J et al. Pulmonary stenosis in complicated monochorionic twin pregnancies: prevalence, management and outcome. Prenat Diagn 2015;35:1085–92.
33. Ortiz JU, Masoller N, Gómez O, Bennasar M, Eixarch E, Lobmaier SM et al. Rate and outcomes of pulmonary stenosis and functional pulmonary atresia in recipient twins with twin-twin transfusion syndrome. Fetal Diagn Ther 2017;41:191–6.
34. Herway C, Johnson A, Moise K, Moise KJ Jr. Fetal intraperitoneal transfusion for iatrogenic twin anemia-polycythemia sequence after laser therapy. Ultrasound Obstet Gynecol 2009;33:592–4.
35. Sunagawa S, Kikuchi A, Kurihara N, Hiroma T, Ono K, Miyachi K et al. Monochorionic twin fetuses showing a reversal of donor- recipient phenotypes in severe twin-twin transfusion syndrome without oligo-polyhydramnios sequence. Congenit Anom (Kyoto) 2008;48:92–6.
36. Ishii K, Murakoshi T, Matsushita M, Sinno T, Naruse H, Torii Y. Transitory increase in middle cerebral artery peak systolic velocity of recipient twins after fetoscopic laser photocoagulation for twin-twin transfusion syndrome. Fetal Diagn Ther 2008;24:470–3.
37. Parra M, Bascuñán J, Valencia C, Rencoret G, Caballero R, Quezada S. Complicaciones tardías de la terapia láser como tratamiento de la transfusión feto-fetal: caso clínico. Rev Chil Obstet Ginecol 2011;76:42–6.
38. Robyr R, Lewi L, Salomon LJ, Yamamoto M, Bernard JP, Deprest J et al. Prevalence and management of late fetal complications following successful selective laser coagulation of chorionic plate anastomoses in twin-totwin transfusion syndrome. Am J Obstet Gynecol 2006;194:796–803.
39. laghekke F, Lopriore E, Lewi L, Middeldorp JM, van Zwet EW, Weingertner A et al. Fetoscopic laser coagulation of the vascular equator versus selective coagulation for twin-to-twin transfusion syndrome: an openlabel randomised controlled trial. Lancet 2014;383:2144–51.
40. Gratacós E, Lewi L, Munoz B, Acosta-Rojas R, Hernandez-Andrade E, Martinez J et al. A classification system for selective intrauterine growth restriction in monochorionic pregnancies according to umbilical artery Doppler flow in the smaller twin. Ultrasound Obstet Gynecol 2007;30:28–34.
41. Quintero R, Bornick P, Morales W, Allen M. Selective photocoagulation of communicating vessels in the treatment of monochorionic twins with selective growth retardation. Am J Obstet Gynecol 2001;185:689–96.
42. Chalouhi GE, Marangoni MA, Quibel T, Deloison B, Benzina N, Essaoui M et al. Active management of selective intrauterine growth restriction with abnormal Doppler in monochorionic diamniotic twin pregnancies diagnosed in the second trimester of pregnancy. Prenat Diagn 2013;33:109–15.
43. Gratacós E, Antolin E, Lewi L, Martínez JM, Hernandez-Andrade E, Acosta-Rojas R et al. Monochorionic twins with selective intrauterine growth restriction and intermittent absent or reversed end-diastolic flow (Type III): feasibility and perinatal outcome of fetoscopic placental laser coagulation. Ultrasound Obstet Gynecol 2008;31:669–75.
44. Lewi L, Valencia C, Gonzalez E, Deprest J, Nicolaides KH. The outcome of twin reversed arterial perfusion sequence diagnosed in the first trimester. Am J Obstet Gynecol 2010;203:213.e1 – 213.e4.
45. Tan T, Sepulveda W. Acardiac twin: a systematic review of minimally invasive treatment modalities. Ultrasound Obstet Gynecol 2003;22:409–19.
46. Sepulveda W, Hasbun J, Dezerega V, Devoto J, Alcalde J. Successful sonographically guided laser ablation of a large acardiac twin at 26 weeks’ gestation. J Ultrasound Med 2004;23:1663–6.
47. Corbacioglu A, Gul A, Bakirci I, Gedikbasi A, Yildirim G. Treatment of twin reversed arterial perfusion sequence with alcohol ablation or bipolar cord coagulation. Int J Gynecol Obstet 2012;117:257–9.
48. Senat MV, Loizeau S, Couderc S, Bernard JP, Ville Y. The value of middle cerebral artery peak systolic velocity in the diagnosis of fetal anemia after intrauterine death of one monochorionic twin. Am J Obstet Gynecol 2003;189:1320–4.
49. Senat MV, Bernard JP, Loizeau S, Ville Y. Blackwell Science, Ltd Management of single fetal death in twin-to-twin transfusion syndrome: a role for fetal blood sampling. Ultrasound Obstet Gynecol 2002;20:360–3.
50. Quarello E, Stirnemann J, Nassar M, Nasr B, Bernard J, Leleu-Huard F et al. Outcome of anaemic monochorionic single survivors following early intrauterine rescue transfusion in cases of feto-fetal transfusion syndrome. BJOG 2008;115:595–601.
51. Nakata M, Sumie M, Murata S, Miwa I, Kusaka E, Sugino N. A case of monochorionic twin pregnancy complicated with intrauterine single fetal death with successful treatment of intrauterine blood transfusion in the surviving fetus. Fetal Diagn Ther 2007;22:7–9.
52. Cavoretto P, Serafini A, Valsecchi L, Lanna M, Rustico MA. Early diagnosis, follow-up, and prenatal treatment of a case of TRAP sequence occurring in a dichorionic triamniotic triplet pregnancy. J Clin Ultrasound 2009;37:350– 3.
53. Nik Lah NA, Che Yaakob CA, Othman MS, Nik Mahmood NM. Twin reverse arterial perfusion sequence. Singapore Med J 2007;48:e335–e337.
54. Fichera A, Zambolo C, Accorsi P, Martelli P, Ambrosi C, Frusca T. Perinatal outcome and neurological follow up of the cotwins in twin pregnancies complicated by single intrauterine death. Eur J Obstet Gynecol Reprod Biol 2009;147:37–40.
Correspondencia:
 Prof. Dr. Mauro Parra-Cordero
Prof. Dr. Mauro Parra-Cordero
 Unidad de Medicina Materno-Fetal, Depto. de Obstetricia y Ginecología, Hospital Clínico Universidad de Chile
Unidad de Medicina Materno-Fetal, Depto. de Obstetricia y Ginecología, Hospital Clínico Universidad de Chile
 [email protected]
[email protected]
 562 2978 8880
562 2978 8880