Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
Serie guías clínicas: parto prematuro
Rev Hosp Clin Univ Chile 2016: 27: 109-122
Mauro Parra-Cordero, Álvaro Sepúlveda-Martínez, Enrique Valdés R.
OBJETIVOS DE LA GUÍA CLÍNICA
Determinar factores de riesgo de parto prematuro espontáneo menor a 34 semanas.
Determinar las medidas de prevención de parto prematuro espontáneo menor a 34 semanas.
Conocer la alta tasa de falsos positivos del diagnóstico clínico de parto prematuro y el papel de la evaluación ecográfica del cérvix.
Conocer el concepto del uso de tocolisis en parto prematuro.
Valorar el papel de los corticoides y sulfato de magnesio en la reducción de morbimortalidad perinatal en el parto prematuro.
Evaluar el papel de los antibióticos en el parto prematuro con membranas íntegras.
¿A QUIÉN VA DIRIGIDA LA PRESENTE GUÍA CLÍNICA?
La siguiente guía va dirigida a matronas, estudiantes de Medicina, becados/residentes de Ginecología y Obstetricia, becados/residentes de Medicina Materno-Fetal, obstetras que se desempeñan en hospitales de 2° y 3° nivel y especialistas en Medicina Materno-Fetal, con el fin de actualizar los conocimientos en el diagnóstico y manejo de gestaciones afectadas por una amenaza de parto prematuro.
NIVEL DE EVIDENCIA Y GRADO DE RECOMENDACIÓN
En la presente guía se utilizará la clasificación de nivel de evidencia y grado de recomendación propuesta por Harbour et al.(1).
NIVEL DE EVIDENCIA
1++: Metaanálisis de alta calidad, revisiones sistemáticas de ERC, o ERC con riesgo muy bajo de sesgo.
1+: Metaanálisis bien diseñados, revisiones sistemáticas de ERC, o ERC con riesgo bajo de sesgo.
1-: Metaanálisis, revisiones sistemáticas de ERC, o ERC con alto riesgo de sesgo.
2++: Revisiones sistemáticas de estudios casocontrol o cohorte de alta calidad, o estudios de caso-control o cohorte de alta calidad con riesgo muy bajo de factores confundentes o con alta probabilidad de que la relación sea causal.
2+: Caso-control o cohortes bien desarrollados con bajo riesgo de factores confundentes, y una probabilidad moderada de que la relación sea causal.
2-: Estudios caso-control o cohorte con alto riesgo de factores confundentes, y riesgo significativo de que la relación no sea causal.
3: Estudios no analíticos, por ejemplo, reporte de casos o serie de casos.
4: Opinión de expertos.
GRADO DE RECOMENDACIÓN
A: Al menos un meta-análisis, revisión sistemática o ERC en categoría 1++, y directamente aplicable a la población objetivo, o
Una revisión sistemática de ERC o un nivel de evidencia consistente principalmente de estudios en categoría 1+ directamente aplicable a la población objetivo y demostrando consistencia global en los resultados.
B: Cantidad de evidencia que incluya estudios en categoría 2++ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados o
Evidencia extrapolada de estudios en categoría 1++ o 1+.
C: Cantidad de evidencia que incluye estudios en categoría 2+ directamente aplicable a la población objetivo y demostrando consistencia global de los resultados, o
Evidencia extrapolada de estudios en categoría 2++.
D: Evidencia nivel 3 o 4, o Evidencia extrapolada de estudios 2+
ANTECEDENTES GENERALES
El parto prematuro es un síndrome y, por lo tanto, tiene múltiples etiologías y muy diversas. A pesar de los grandes avances en el conocimiento de sus diversas etiopatogenias, su incidencia se mantiene constante en las últimas décadas e incluso en aumento en algunos países desarrollados, y es una de las principales causas de morbimortalidad materna y perinatal(2-4).
El parto prematuro se define como aquel embarazo que finaliza, espontánea o por indicación médica, antes de las 37 semanas de gestación; sin embargo, dada su relevancia relativa, el enfoque actual de las estrategas de cribado y prevención del parto prematuro se ha concentrado específicamente en los casos que se presentan antes de las 34 semanas de gestación, los cuales representan el 60 a 70% del total de la morbimortalidad perinatal(2,3).
La incidencia del parto prematuro en nuestro país es alrededor del 6%, siendo aproximadamente un 3% para aquellos que se presentan antes de las 34 semanas de gestación; sin embargo, en los grandes centros asistenciales de nuestro país, al igual que en la gran mayoría de los países desarrollados, la incidencia global del parto prematuro y de aquellos menores de 34 semanas, es aproximadamente 10% y 5%, respectivamente(5).
Los partos prematuros se pueden clasificar operacionalmente en: 1) Iatrogénicos o por indicación médica y 2) Espontáneos. Los partos prematuros espontáneos, incluyendo a las roturas prematuras de membranas de pretérmino, representan alrededor de dos tercios del total de partos prematuros, mientras que los iatrogénicos, o por indicación médica, el restante tercio de las causas de prematuridad. Los partos prematuros espontáneos tienen dos grandes presentaciones clínicas: a) con membranas íntegras y b) membranas rotas. Estas presentaciones clínicas dividen equitativamente las causas de prematuridad espontánea, y tienen como sus principales causas a las originadas por infecciones ascendentes en el canal del parto, sobre-distención uterina, incompetencia o insuficiencia cervical y un grupo asociado también a isquemia útero-placentaria (disfunción placentaria)(6).
En las últimas décadas la incidencia del parto prematuro no ha disminuido y en los últimos años hemos visto un considerable aumento de la sobrevida de recién nacidos muy prematuros gracias a los avances de las Unidades de Cuidados Neonatales; sin embargo, un mayor impacto sobre la morbimortalidad asociada al parto prematuro se obtendrá mediante el desarrollo de un método sensible que permita detectar a las mujeres en alto riesgo de parto prematuro y a través de desarrollar estrategias eficaces para prevenir esta complicación.
CRIBADO DEL PARTO PREMATURO ESPONTÁNEO
¿Es el antecedente de un parto prematuro un factor de riesgo de prematuridad?
• Mujeres con un embarazo único y antecedente de un parto prematuro espontáneo deberían iniciar progesterona profiláctica entre 16 y 24 semanas de gestación para reducir el riesgo de un nuevo parto prematuro. (Grado de recomendación A)
• El uso de un cerclaje en mujeres con historia de un parto prematuro y cérvix menor a 25 mm es recomendable para reducir el riesgo de parto prematuro. (Grado de recomendación A)
• No hay evidencia suficiente para sugerir que la combinación de progesterona y cerclaje en mujeres con antecedentes de parto prematuro adiciona un beneficio superior al de cada uno por separado. (Grado de recomendación B)
• El diagnóstico y tratamiento de vaginosis bacteriana está recomendado solo en mujeres con historia previa de parto prematuro. (Grado de recomendación A)
• El uso de pesario vaginal en mujeres con historia previa de parto prematuro es una opción para reducir el riesgo de prematuridad. (Grado de recomendación C)
Las causas de parto prematuro espontáneo y de la rotura de membranas se desconocen, pero existen algunos factores de riesgo que se han estudiado y asociado estadísticamente con su aparición. Como ejemplo de lo anterior están las variables sociobiológicas y antecedentes obstétricos, como la edad materna, la raza, el índice de masa corporal, el consumo de cigarrillos, la paridad, y el antecedente de partos prematuros previos que se asocian a un mayor riesgo de presentar un parto prematuro(7-10). Por otro lado, durante el curso del embarazo existen algunos factores que se han asociado a un mayor riesgo de prematurez. Entre ellos vale la pena destacar a las infecciones cérvico-vaginales, la bacteriuria asintomática, el sangrado genital, las malformaciones fetales y los embarazos múltiples. Al emplear esta información, en forma conjunta, para estimar su capacidad en la predicción de parto prematuro menor a 37 semanas nos encontramos que tiene solo una sensibilidad menor al 40%, con una tasa de falsos positivos de 15%. Empleando un análisis multivariado y determinado la capacidad de detección de partos prematuros menores a 34 semanas, con una tasa de falsos positivos fija de 5%, esta alcanza a 30%(8,11-13). Sin embargo, dado que el factor más importante en la historia clínica es el antecedente de un parto prematuro, solo sería útil para aquellas mujeres con al menos un parto, dejando sin la posibilidad de tener un cribado al 30 a 50% de la población de embarazadas(14). Muchos autores han evaluado la utilidad de la medición de la longitud cervical en el cribado de mujeres en riesgo de parto prematuro(15). Es así como en mujeres con antecedentes de partos prematuros previos, anomalías uterinas y/o cirugías cervicales, la posibilidad de parto prematuro aumenta si el cérvix es <25 mm. En la evaluación ecográfica seriada entre las 14-24 semanas de gestación de la longitud cervical por vía transvaginal se observó un aumento significativo del riesgo de partos prematuros <34 semanas de 10% al 30% en el grupo con cérvix menor de 25 mm. Por lo tanto, este grupo se beneficiaría con el uso de progesterona y/o cerclaje(16).
Desde el año 1990 que existe evidencia científica del beneficio de emplear progesterona como estrategia de prevención de partos prematuros en mujeres con antecedentes de partos prematuros previos; sin embargo, esta evidencia recién se fortaleció y adquirió rango de recomendación en una serie de países desde la publicación de dos estudios aleatorizados, controlados el año 2003. Ambos estudios demostraron que el uso de progesterona natural por vía vaginal o parenteral es capaz de reducir el riesgo de partos prematuros en mujeres con antecedentes de partos prematuros previos(17,18). [Evidencia Ib]
El cerclaje cervical está indicado en mujeres con antecedentes de aborto y/o partos prematuros espontáneos de segundo trimestre a través de hacer un cerclaje electivo después de las 14 semanas. Otra alternativa, es la colocación del cerclaje solo en aquellas mujeres con cérvix menor de 25 mm en una evaluación seriada de la longitud cervical entre 16 y 24 semanas de gestación. Esta última alternativa evita aproximadamente un 50% de los cerclajes, manteniendo la misma tasa de prematurez(16,19).
En un estudio aleatorizado de mayor tamaño en pacientes con historia de parto prematuro, se demostró que el cerclaje reduce el riesgo de parto prematuro menor a 24 y menor a 37 semanas en 66% y 25%, respectivamente (RR 0,44 [0,21-0,92] y 0,75 [0,60-0,93]). Además, el grupo que recibió un cerclaje tuvo una menor tasa de muerte perinatal que el grupo control (RR 0,54 [0,29-0,99])(20). Esta información ha sido corroborada en dos metaanálisis que incluyeron 5 estudios de diseño similar. Estos metaanálisis demostraron una reducción del parto prematuro menor a 35 semanas (RR 0,70 [0,5-0,89]) y morbimortalidad perinatal compuesta (RR 0,64 [0,45-0,91])(21,22). Finalmente, hay una insuficiente evidencia para justificar el uso combinado de progesterona y cerclaje en mujeres con historia previa de parto prematuro(23). [Evidencia Ia]
Un par de metaanálisis publicados en la Cochrane Database Systematic Review muestran contradictorias conclusiones en cuanto a la utilidad del cribado y tratamiento de vaginosis bacteriana para reducir parto prematuro. El más reciente, con solo un estudio incluido que cumplía los criterios de selección, muestra que la pesquisa y tratamiento de la vaginosis bacteriana reduce el riesgo de parto prematuro menor a 37 semanas en 45% (RR= 0,55 [0,41-0,75] y reduce también los partos prematuros con bajo (menos de 2.500 grs.) y extremadamente bajo peso (menos de 1.500 grs) en 52% y 66%, respectivamente(24). El otro metaanálisis, con 15 estudios analizados, concluye que no existe evidencia que el cribado y tratamiento de la vaginosis bacteriana reduzca el parto prematuro menor de 37 semanas en pacientes de bajo o alto riesgo; sin embargo, ellos plantean que cuando el tratamiento se inició antes de las 20 semanas hubo una reducción significativa del riesgo de prematuridad de 37% y que la pesquisa y tratamiento en mujeres con antecedentes de partos prematuros previos reduce la incidencia de membranas rotas (86%) y bajo peso al nacimiento (69%)(25). Por lo tanto, hasta no contar con un nuevo metaanálisis u otros estudios randomizados al respecto, podemos recomendar pesquisa sistemática y tratamiento de vaginosis bacteriana solo en mujeres con antecedentes de partos prematuros. [Evidencia Ia]
El uso de pesario vaginal es útil en reducir el riesgo de parto prematuro menor a 34 semanas en mujeres con antecedentes de parto prematuro y cérvix corto menor de 25 mm(26). [Evidencia III]
¿Es recomendable un cribado universal de parto prematuro?
• Es recomendable adoptar una estrategia universal de cribado de parto prematuro que incluya la medición de la longitud cervical entre 20+0 – 24+6 semanas. (Grado de recomendación B)
La principal justificación de la implementación de un cribado universal es la opción de las pacientes a un esquema de prevención efectivo. Afortunadamente, en los últimos años existe suficiente evidencia que postula que la adición de progesterona natural a mujeres asintomáticas con historia previa de parto prematuro y/o con cérvix corto en la evaluación ultrasonográfica de rutina en el segundo trimestre de la gestación, reduce significativamente el riesgo de parto prematuro espontáneo.
En mujeres asintomáticas sin antecedentes previos de riesgo, la estimación del riesgo de parto prematuro aumenta exponencialmente en la medida que el cérvix es de menor longitud en la evaluación realizada entre las 20-24 semanas de gestación en embarazos únicos. La sensibilidad de la evaluación ecográfica del cérvix entre 20-24 semanas de gestación para aquellos partos prematuros de embarazos únicos que se producen bajo las 34 semanas de gestación es alrededor de un 50%(10,27). Recientemente una revisión sistemática sobre el papel de la evaluación cervical ultrasonográfica en la predicción de parto prematuro en pacientes asintomáticas entre 20-24 semanas, concluyó que una longitud cervical menor de 25 mm tiene una razón de verosimilitud de 3 para partos prematuros menores de 34 semanas. Este mismo grupo demostró que en aquellas mujeres con antecedentes de partos prematuros, la longitud cervical menor de 25 mm entre 20-24 semanas también aumenta el riesgo de prematuridad en 3 veces(28). La combinación de los factores clínicos y la evaluación ecográfica de la longitud cervical entre 20-24 semanas en los embarazos únicos de bajo riesgo, puede llevar la tasa de detección de partos prematuros menores de 34 semanas al 60%, manteniendo una tasa de falsos positivos del 5%(10).
¿Qué intervenciones han demostrado utilidad en prevenir parto prematuro en mujeres asintomáticas y sin factores de riesgo?
• Mujeres con cérvix corto <25 mm pesquisado en ecografía entre 20+0 - 24+6 semanas de gestación debiesen recibir progesterona profiláctica. (Grado de recomendación A)
• No es recomendable para reducir el riesgo de parto prematuro el uso de cerclaje. (Grado de recomendación A)
• Existe aún insuficiente evidencia que el uso de pesario vaginal sea útil en reducir el riesgo en una población asintomática con cérvix corto (menor a 25 mm) en el segundo trimestre de la gestación. (Grado de recomendación A)
Dos estudios aleatorizados realizados entre 20-25 semanas de gestación demostraron la utilidad de la progesterona natural en prevenir parto prematuro espontáneo en mujeres con cérvix corto. El primero de ellos empleó óvulos de 200 mg de progesterona vaginal en mujeres con cérvix menor a 15 mm y demostró una reducción del riesgo de parto prematuro espontáneo de 44% (RR 0,56 [0,36-0,86])(29). El otro estudio empleó progesterona en gel de 90 mg en mujeres con cérvix corto entre 10-20 mm y demostró una reducción de parto prematuro espontáneo similar al primer estudio (RR 0,55 [0,33-0,92]); sin embargo, este estudio, a diferencia del anterior, demostró una significativa reducción de la morbimortalidad compuesta (RR 0,57 [0,33-0,99])(30). Finalmente, un metaanálisis ha confirmado los resultados de los dos estudios precedentes en cuanto a la utilidad de la progesterona en reducir el riesgo de prematuridad. Este metaanálisis sugiere el uso de un cérvix menor a 25 mm para incorporar pacientes embarazadas al uso de progesterona(31). [Evidencia Ia] Aún más, existe evidencia de costo-efectividad que también justifica la incorporación de este diseño de cribado universal en nuestra población(32,33).
Aunque existe un estudio español en mujeres asintomáticas con cérvix menor a 25 mm a las 20-23 semanas de gestación que demuestra que el uso de pesario vaginal redujo el riesgo de parto prematuro menor a 34 semanas desde un 27% a 6% (RR 0,18 [0,08-0,27])(34), hay otro estudio recientemente finalizado y conducido por la Fetal Medicine Foundation que refuta dichos resultados(35). [Evidencia Ib]
Por el contrario, el uso de cerclaje no ha demostrado utilidad en mujeres asintomáticas con cérvix corto en el segundo trimestre de la gestación(36). [Evidencia Ia]
TRATAMIENTO Y/O MANEJO DEL PARTO PREMATURO ESPONTÁNEO
¿Es posible determinar un mayor riesgo de parto prematuro en pacientes que se hospitalizan por amenaza de parto prematuro?
• Cérvix menor a 15 mm aumenta significativamente el riesgo de parto prematuro en los próximos 7 días. (Grado de recomendación B)
• Cérvix ≥30 mm reduce significativamente el riesgo de parto prematuro en los próximos 7 días. (Grado de recomendación B)
• El conocer la información sobre la evaluación ecográfica de la longitud cervical es útil para determinar un grupo de alto y bajo riesgo de parto prematuro en los próximos 7 días en mujeres con síntomas de parto prematuro. (Grado de recomendación A)
Varios estudios han señalado que el diagnóstico clínico de amenaza de parto prematuro (APP) es capaz de predecir solo al 10% de los embarazos que realmente tendrán su parto antes de los 7 días de su hospitalización(37). Habitualmente las embarazadas con APP reciben tocolisis y corticoides como parte de un esquema estandarizado; sin embargo, debido a la alta tasa de falsos positivos del diagnóstico de APP (90%), se hace necesario poder contar con una herramienta efectiva que sea capaz de diferenciar entre un verdadero y falso parto prematuro. La evaluación de la longitud cervical ecográfica y la determinación de la concentración cervical de fibronectina fetal cumplen con ese objetivo y, por lo tanto, sería posible reservar el uso de tocolisis y corticoides para la población con un verdadero riesgo de parto prematuro.
La evidencia actual coincide en que cérvix menor a 15 mm de longitud tienen una probabilidad de 50% de presentar un parto en los próximos 7 días, mientras que el grupo con cérvix mayores de esa longitud, especialmente menos de 30 mm, solo tienen un 1% de riesgo (13,38). Sin embargo, para fibronectina fetal los estudios son controversiales. Gómez y col. en población Chilena encontraron que la combinación de cérvix corto y fibronectina fetal positiva (mayor que 50 ng/mL) es capaz de predecir al 75% de los verdaderos partos prematuros(13). Por el contrario, el grupo del King´s College de Londres no mostró beneficios en incorporar la fibronectina fetal al cálculo de riesgo(39). [Evidencia IIa]
Dos estudios aleatorizados(40,41) sobre el rol clínico de conocer o no el valor de fibronectina en mujeres con APP en general, no han demostrado ser de gran utilidad en reducir intervenciones innecesarias, salvo en uno de esos estudios(40), que demostró que el conocer que había una fibronectina negativa reducía las horas de estadía hospitalaria en un 40%. [Evidencia Ib]
Sin embargo, un par de estudios sobre el papel que juega el conocer la información de la longitud cervical en mujeres que ingresan con APP ha demostrado una mayor utilidad(42,43), especialmente Alfirevic y col. quien aleatorizó las pacientes con APP de acuerdo al uso o no de la evaluación ecográfica de la longitud cervical. El grupo control, o sea sin ecografía, fue manejado bajo los criterios de uso de tocolisis y corticoides estándares, mientras que el grupo con ecografía recibió dichos medicamentos, tomando esencialmente en cuenta el resultado de la longitud cervical. Este estudio demostró que la introducción de la longitud cervical a la decisión sobre el uso de tocolisis y corticoides reduce en forma significativa un empleo innecesario de ellos sin afectar la tasa de prematuridad entre ambos grupos(43). [Evidencia Ib]
¿Qué embarazadas con APP deben recibir tocolisis y de qué tipo?
• Las pacientes con APP definidas en riesgo de parto prematuro dentro de los próximos 7 días deben recibir intervención con tocolisis y corticoides. (Grado de recomendación B)
• Uso de tocolisis hasta 48 horas con el objetivo de emplear corticoides. (Grado de recomendación A)
• Los tocolíticos que han demostrado ser más útiles que el placebo en reducir dinámica uterina y prolongar la gestación por al menos 48 horas son beta miméticos (fenoterol), bloqueadores de los canales de calcio (sulfato de magnesio y nifedipino), bloqueador receptor de ocitocina (atosiban) e inhibidores de la COX (indometacina). (Grado de recomendación A)
• Indometacina y el nifedipino debiesen ser empleados como tocolíticos de primera línea. (Grado de recomendación A)
• La indometacina debe usarse con precaución después de las 32 semanas. (Grado de recomendación C)
• Los betamiméticos, como el fenoterol, se han asociados a efectos adversos maternos severos en la literatura internacional, pero dichos efectos adversos no se han reportado en nuestro país y, por lo tanto, debiese ser empleado como un fármaco de segunda línea. (Grado de recomendación B y D)
• El sulfato de magnesio debiese ser considerado un fármaco de segunda línea, pues ha demostrado prolongar la gestación en al menos 48 horas y a la vez tiene un efecto neuroprotector fetal. (Grado de recomendación A)
Los tocolíticos no han demostrado mejorar el pronóstico perinatal y dado sus efectos adversos maternos, ella debiese reservarse solo para prolongar la gestación ante la necesidad de emplear agentes de demostrada utilidad en reducción de riesgos en nacimientos prematuros, como son los corticoides y el sulfato de magnesio. En general no debiese ser utilizada antes de las 24, ni después de las 34 semanas de gestación(44). [Evidencia Ib] La tocolisis está contraindicada en las siguientes circunstancias:
• Muerte intrauterina
• Malformación incompatible con la vida
• RBNS sospechoso
• Preeclampsia severa o eclampsia
• Metrorragia con inestabilidad hemodinámica
• Corioamnionitis
• Contraindicación materna al fármaco tocolítico específico
No hay evidencia para emplear tocolíticos antes de la viabilidad de la gestación pues la morbimortalidad perinatal en ese periodo de la gestación es demasiada alta para justificar la exposición al riesgo de los fármacos tocolíticos en la embarazada. Existe una excepción a esta regla cuando estaría indicado su uso en cirugías abdominales u otros procedimientos que teóricamente pueden aumentar la contractilidad uterina(45). [Evidencia IV]
Los agentes empleados en tocolisis obedecen a efectos farmacológicos inhibitorios de la contracción miometrial. Entre ellos conocemos a los betamiméticos (fenoterol), bloqueador competitivo de los canales de calcio (sulfato de magnesio), bloqueadores de los canales de calcio voltaje dependientes (nifedipino), inhibidor de la ciclooxigenasa (indometacina) y bloqueador del receptor de ocitocina (atosiban).
Aunque existe diversa y contradictoria información en esta área de la obstetricia, recientes metaanálisis señalan que los tocolíticos de primera línea debiesen ser la indometacina y nifedipino(46). [Evidencia Ia]
Los dos fármacos endovenosos, betamiméticos y sulfato de magnesio, han demostrado también tener una significativa prolongación de la gestación por al menos 48 horas al compararlos con placebo (2,76 [1,58-4,94] y 2,41 [1,27-4,55], respectivamente). Sus efectos adversos maternos son superiores a placebo y al compararlos con los otros fármacos. [Evidencia Ia]
El principal inconveniente de atosiban, junto con no estar avalado su uso por la FDA de Estados Unidos debido a efectos adversos neonatales reportados a su uso, es su alto costo en comparación con los otros tocolíticos de similar, o superior, efectividad(47) [Evidencia IV]
La indometacina se ha asociado al cierre reversible del ductus arterioso, por lo tanto, debe utilizarse con precaución e idealmente con control de dicho efecto por ecocardiografía fetal, si se decide emplear después de las 32 semanas de gestación.
El sulfato de magnesio es aún empleado como tocolítico en muchos países, incluido Estados Unidos y en particular en nuestro Hospital existe una vasta experiencia en su uso y seguridad. Como se mencionó anteriormente, la literatura es contradictoria en cuanto a su efectividad. Mientras un metaanálisis muestra que el sulfato de magnesio no es superior a un grupo control compuesto por una mezcla de otros tocolíticos y/o placebo (48), otro metaanálisis más reciente señala que el sulfato de magnesio comparado con placebo (3 estudios) es capaz de prolongar la gestación en al menos 48 horas, pero con una mayor tasa de efectos adversos maternos(46). Un aspecto interesante y relevante al momento de tomar decisiones en cuanto al uso de tocolíticos de primera o segunda línea, y que mencionaremos más adelante, es el efecto neuroprotector de este fármaco (49). [Evidencia Ia]. Ver anexo 2.
¿El uso de corticoides mejora el pronóstico perinatal?
• Un curso único de corticoides es recomendable entre 24+0 y 33+6 semanas. (Grado de recomendación A)
• Un único curso de rescate de corticoides está indicado en embarazadas con persistencia de APP y cuya última dosis fue indicada 7 días antes y está aún por debajo de las 34 semanas de gestación. (Grado de recomendación B)
• En partos inminentes está indicada una dosis única de corticoides. (Grado de recomendación D)
La intervención más efectiva en mejorar el pronóstico perinatal es el uso de corticoides antenatales. Se recomienda un curso único de corticoides entre las 24+0 y 33+6 semanas de gestación a pacientes en riesgo de parto prematuro en los próximos 7 días. El uso de corticoides profilácticamente en gestaciones en riesgo de parto prematuro reduce la mortalidad perinatal (0,69 [0,58-0,81]), síndrome de distrés respiratorio (0,66 [0,59-0,73]), hemorragia intraventricular (0,54 [0,43-0,69]), enterocolitis necrotizante (0,46 [0,29-0,74])(50) . [Evidencia Ia]
Un estudio aleatorizado y un metaanálisis concluyeron que una dosis única de rescate de corticoides en embarazos con riesgo inminente de parto prematuro, es aún beneficioso si la última dosis se había colocado hace 7 días o más y la edad gestacional es aún menor que 34 semanas(51,52); sin embargo, este último metaanálisis contraindica el uso repetitivo de este curso de rescate. Además, una dosis única de corticoides está indicada en casos excepcionales de partos inminentes(53). [Evidencia Ia]
La recomendación del uso de corticoides es un curso de betametasona, la cual incluye dos dosis de 12 mg separadas por 24 horas. Una terapia alternativa es dexametasona en dosis de 6 mg. cada 12 horas por 4 dosis(54,55). [Evidencia III]
¿Es útil el sulfato de magnesio como neuroprotector fetal?
• Uso de sulfato de magnesio como neuroprotector debe ser usado antes de las 34 semanas en casos de parto prematuro inminente. La dosis de sulfato de magnesio de 4 grs/carga y 2 gr/hora debe ser administrada por al menos 24 horas (Grado de recomendación A)
Recientemente se ha establecido que el sulfato de magnesio en dosis de carga de 4 gr y mantención de 2 gr/hora, aplicado al menos 24 horas antes de un parto prematuro menor que 34 semanas de gestación, es capaz de reducir significativamente el riesgo de parálisis cerebral (0,68 [0,54-0,87]). Esta evidencia se generó en base a 3 estudios controlados aleatorizados (56-58) y un metaanálisis que confirmaron la utilidad de este fármaco en neuroprotección fetal, reduciendo significativamente la probabilidad de parálisis cerebral (RR 0,7 [0,55-0,91])(59). [Evidencia Ia]
¿Es útil es uso de antibióticos en APP?
• No está indicado el uso de antibióticos en la infección intraamniótica (corioamnionitis subclínica) asociada a APP con membranas íntegras. (Grado de recomendación A)
• La amniocentesis debe reservarse para refractariedad a la terapia tocolítica de primera línea, reaparición de dinámica uterina, y cérvix menor a 15 mm. (Grado de recomendación C y D)
El uso de antibióticos no está recomendado en amenazas de parto prematuro con membranas íntegras, pues a pesar que reduce el riesgo de infección materna no prolonga la gestación. Además hubo una tendencia al aumento de mortalidad neonatal en el grupo que empleo antibiótico(60-62). [Evidencia Ia]
La amniocentesis debiese reservarse en base a la evidencia disponible para aquellos grupos de mayor riesgo de presentar infección intraamniótica como son las mujeres con refractariedad a la tocolisis, reaparición de dinámica uterina y para aquellas mujeres con cérvix menor a 15 mm al momento del ingreso por APP(63). {Vaisbuch E 2010} [Evidencia III y IV]. Ver anexo 3.
REFERENCIAS
1. Harbour R, Miller J. A new system for grading recommendations in evidence based guidelines. BMJ 2001;323:334–6.
2. Marlow N, Wolke D, Bracewell M, Samara M. Neurologic and developmental disability at six years of age after extremely preterm birth. N Engl J Med 2005;352:9–19.
3. Petrou S. The economic consequences of preterm birth during the first 10 years of life. BJOG 2005;112 (suppl 1):10–15.
4. Saigal S, Doyle LW. An overview of mortality and sequelae of preterm birth from infancy to adulthood. Lancet 2008;371:261–9.
5. Government Statistical Service for the Department of Health, 2002-2003.
6. Romero R. Prevention of spontaneous preterm birth: the role of sonographic cervical length in identifying patients who may benefit from progesterone treatment. Ultrasound Obstet Gynecol 2007;30:675–86.
7. Honest H, Backman LM, Coomarasamy A, Gupta JK, Kleijnen J, Khan KS. Accuracy of cervical transvaginal sonography in predicting preterm birth: a systematic review. Ultrasound Obstet Gynecol 2003;22:305–22.
8. To Ms, Fonseca E, Molina FS, Cacho AM, Nicolaides KH. Maternal characteristics and cervical lenght in the prediction of spontaneous early preterm delivery in twins. Am J Obstet Gynecol 2006;194:1360–5.
9. E. Celik, M.To, K. Gajewska, GCS Smith, KH Nicolaides. Cervical length and obstetric history predict spontaneous preterm birth: development and validation of a model to provide individualized risk assessment. Ultrasound Obstet Gynecol 2008;31:549–54.
10. To MS, Skentou CA, Royston P, Yu CK, Nicolaides KH. Prediction of patient-specific risk of early preterm delivery using maternal history and sonographic measurement of cervical length: a population-based prospective study. Ultrasound Obstet Gynecol 2006;27:362–7.
11. Hillier SL, Nugent RP, Eschenbach DA, Krohn MA, Gibbs RS, Martin DH et al. Association between bacterial vaginosis and preterm delivery of a low-birth-weight infant. The Vaginal Infections and Prematurity Study Group. N Engl J Med 1995;333:1737–42.
12. McDonald H, Brocklehurst P, et al. Antibiotics for treating bacterial vaginosis in pregnancy (Cochrane Review). In: The Cochrane Library, 3, 2003.
13. Gómez R, Romero R, Nien JK, Medina L, Carstens M, Kim YM et al. Idiopathic vaginal bleeding during pregnancy as the only clinical manifestation of intrauterine infection. J Matern Fetal Neonatal Med 2005;18:31–7.
14. Edlow AG, Srinivas SK, Elovitz MA. Secondtrimester loss and subsequent pregnancy outcomes: What is the real risk? Am J Obstet Gynecol 2007;197:581.e1–581.6.
15. Iams JD, Goldenberg RL, Meis PJ, Mercer BM, Moawad A, Das A et al. The length of the cervix and the risk of spontaneous premature delivery. National Institute of Child Health and Human Development Maternal Fetal Medicine Unit Network. N Engl J Med 1996;334:567–72.
16. Althuisius SM, Dekker GA, van Geijn HP, Bekedam DJ, Hummel P. Cervical incompetence prevention randomized cerclage trial (CIPRACT): study design and preliminary results. Am J Obstet Gynecol 2000;183:823–9.
17. Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH et al. Prevention of recurrent preterm delivery by 17 alphahydroxyprogesterone caproate. N Engl J Med 2003;348:2379–85.
18. Da Fonseca EB, Bittar RE, Carvalho MH, Zugaib M. Prophylactic administration of progesterone by vaginal suppository to reduce the incidence of spontaneous preterm birth in women at increased risk: a randomized placebo-controlled double-blind study. Am J Obstet Gynecol 2003;188:419–24.
19. To MS, Skentou C, Liao AW, Cacho A, Nicolaides KH. Cervical length and funneling at 23 weeks of gestation in the prediction of spontaneous early preterm delivery. Ultrasound Obstet Gynecol 2001;18:200–3.
20. Owen J, Hankins G, Iams JD, Berghella V, Sheffield JS, Perez-Delboy A et al. Multicenter randomized trial of cerclage for preterm birth prevention in high-risk women with shortened midtrimester cervical length. Am J Obstet Gynecol 2009;201:375.e1–8.
21. Berghella V, Odibo AO, To MS, Rust OA, Althuisius SM. Cerclage for short cervix on ultrasonography: meta-analysis of trials using individual patient-level data. Obstet Gynecol 2005;106:181–9.
22. Berghella V, Rafael TJ, Szychowski JM, Rust OA, Owen J. Cerclage for short cervix on ultrasonography in women with singleton gestations and previous preterm birth: a metaanalysis. Obstet Gynecol 2011;117:663–71.
23. Berghella V, Keeler SM, To MS, Althuisius SM, Rust OA. Effectiveness of cerclage according to severity of cervical length shortening: a meta-analysis. Ultrasound Obstet Gynecol 2010;35:468–73.
24. Swadpanich U, Lumbiganon P, Prasertcharoensook W, Laopaiboon M. Antenatal lower genital tract infection screening and treatment programs for preventing preterm delivery. Cochrane Database Syst Rev 2008 Apr 16;(2):CD006178.
25. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy. Cochrane Database Syst Rev 2007 Jan 24;(1):CD000262.
26. Alfirevic Z, Owen J, Carreras Moratonas E, Sharp AN, Szychowski JM, Goya M. Vaginal progesterone, cerclage or cervical pessary for preventing preterm birth in asymptomatic singleton pregnant women with a history of preterm birth and a sonographic short cervix. Ultrasound Obstet Gynecol 2013;41:146–51.
27. Heath VC, Southall TR, Souka AP, Elisseou A, Nicolaides KH. Cervical length at 23 weeks of gestation: prediction of spontaneous preterm delivery. Ultrasound Obstet Gynecol 1998;12:312–7.
28. Crane JM, Hutchens D. Transvaginal sonographic measurement of cervical length to predict preterm birth in asymptomatic women at increased risk: a systematic review. Ultrasound Obstet Gynecol 2008;31:579–87.
29. Fonseca EB, Celik E, Parra M, Singh M, Nicolaides KH. Progesterone and the risk of preterm birth among women with a short cervix. N Engl J Med 2007;357:462–9.
30. Hassan SS, Romero R, Vidyadhari D, Fusey S, Baxter JK, Khandelwal M et al. Vaginal progesterone reduces the rate of preterm birth in women with a sonographic short cervix: a multicenter, randomized, double-blind, placebo-controlled trial. Ultrasound Obstet Gynecol 2011;38:18–31.
31. Romero R, Nicolaides K, Conde-Agudelo A, Tabor A, O’Brien JM, Cetingoz E et al. Vaginal progesterone in women with an asymptomatic sonographic short cervix in the midtrimester decreases preterm delivery and neonatal morbidity: a systematic review and metaanalysis of individual patient data. Am J Obstet Gynecol 2012;206:124.e1–19.
32. Cahill AG, Odibo AO, Caughey AB, Stamilio DM, Hassan SS, Macones GA et al. Universal cervical length screening and treatment with vaginal progesterone to prevent preterm birth: a decision and economic analysis. Am J Obstet Gynecol 2010;202:548.e1–8.
33. Werner EF, Han CS, Pettker CM, Buhimschi CS, Copel JA, Funai EF et al. Universal cervical-length screening to prevent preterm birth: a cost-effectiveness analysis. Ultrasound Obstet Gynecol 2011;38:32–7.
34. Goya M, Pratcorona L, Merced C, Rodó C, Valle L, Romero A et al. Cervical pessary in pregnant women with a short cervix (PECEP): an open-label randomised controlled trial. Lancet 2012;379:1800–6.
35. Nicolaides KH, Syngelaki A, Poon LC, Picciarelli G, Tul N, Zamprakou A et al. A Randomized Trial of a Cervical Pessary to Prevent Preterm Singleton Birth. N Engl J Med 2016;374:1044–52.
36. To MS, Alfirevic Z, Heath VC, Cicero S, Cacho AM, Williamson PR et al. Cervical cerclage for prevention of preterm delivery in women with short cervix: randomised controlled trial. Lancet 2004;363:1849–53.
37. Fuchs IB, Henrich W, Osthues K, Dudenhausen JW. Sonographic cervical length in singleton pregnancies with intact membranes presenting with threatened preterm labor. Ultrasound Obstet Gynecol 2004;24:554–7.
38. Tsoi E, Fuchs IB, Rane S, Geerts L, Nicolaides KH. Sonographic measurement of cervical length in threatened preterm labor in singleton pregnancies with intact membranes. Ultrasound Obstet Gynecol 2005;25:353–6.
39. Tsoi E, Akmal S, Geerts L, Jeffery B, Nicolaides KH. Sonographic measurement of cervical length and fetal fibronectin testing in threatened preterm labor. Ultrasound Obstet Gynecol 2006;27:368–72.
40. Plaut MM, Smith W, Kennedy K. Fetal fibronectin: the impact of a rapid test on the treatment of women with preterm labor symptoms. Am J Obstet Gynecol 2003;188:1588–93.
41. Grobman WA, Welshman EE, Calhoun EA. Does fetal fibronectin use in the diagnosis of preterm labor affect physician behavior and health care costs? A randomized trial. Am J Obstet Gynecol 2004;191:235–40.
42. Ness A, Visintine J, Ricci E, Berghella V. Does knowledge of cervical length and fetal fibronectin affect management of women with threatened preterm labor? A randomized trial. Am J Obstet Gynecol 2007;197:426.e1–7.
43. Alfirevic Z, Tabor A. Pregnancy loss rates after midtrimester amniocentesis. Obstet Gynecol 2007;109:1203–4.
44. Anotayanonth S, Subhedar NV, Garner P, Neilson JP, Harigopal S. Betamimetics for inhibiting preterm labour. Cochrane Database Syst Rev 2004 Oct 18;(4):CD004352.
45. Allen JR, Helling TS, Langenfeld M. Intraabdominal surgery during pregnancy. Am J Surg 1989;158:567–9.
46. Haas DM, Caldwell DM, Kirkpatrick P, McIntosh JJ, Welton NJ. Tocolytic therapy for preterm delivery: systematic review and network meta-analysis. BMJ 2012; 345: e6226.
47. Hayes E, Moroz L, Pizzi L, Baxter J. A cost decision analysis of 4 tocolytic drugs. Am J Obstet Gynecol 2007 Oct;197(4):383.e1–6.
48. Crowther CA, Hiller JE, Doyle LW. Magnesium sulphate for preventing preterm birth in threatened preterm labour. Cochrane Database Syst Rev 2002;(4):CD001060.
49. Norton ME, Merrill J, Cooper BA, Kuller JA, Clyman RI. Neonatal complications after the administration of indomethacin for preterm labor. N Engl J Med 1993;329:1602–7.
50. Roberts D, Dalziel S. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev 2006 Jul 19;(3):CD004454.
51. Garite TJ, Kurtzman J, Maurel K, Clark R. Impact of a ‘rescue course’ of antenatal corticosteroids: a multicenter randomized placebo-controlled trial. Am J Obstet Gynecol 2009;200:248.e1–9.
52. Crowther CA, McKinlay CJ, Middleton P, Harding JE. Repeat doses of prenatal corticosteroids for women at risk of preterm birth for improving neonatal health outcomes. Cochrane Database Syst Rev 2011 Jun 15;(6):CD003935.
53. Antenatal corticosteroids revisited: repeat courses. NIH Consensus Statement 2000.
54. Ballard PL, Ballard RA. Scientific basis and therapeutic regimens for use of antenatal glucocorticoids. Am J Obstet Gynecol 1995;173:254–62.
55. ACOG Committee on Obstetric Practice. ACOG Committee Opinion No. 475: antenatal corticosteroid therapy for fetal maturation. Obstet Gynecol 2011;117(2 Pt 1):422–4.
56. Crowther CA, Hiller JE, Doyle LW, Haslam RR. Effect of magnesium sulfate given for neuroprotection before preterm birth: a randomized controlled trial. JAMA 2003;290:2669–76.
57. Marret S, Marpeau L, Zupan-Simunek V, Eurin D, Lévêque C, Hellot MF et al. Magnesium sulphate given before very-preterm birth to protect infant brain: the randomised controlled PREMAG trial. BJOG 2007;114:310–8.
58. Rouse DJ, Hirtz DG, Thom E, Varner MW, Spong CY, Mercer BM et al. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. N Engl J Med 2008;359:895–905.
59. Doyle LW, Crowther CA, Middleton P, Marret S, Rouse D. Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus. Cochrane Database Syst Rev 2009 Jan 21;(1):CD004661.
60. Romero R, Yoon BH, Mazor M, Gomez R, Diamond MP, Kenney JS et al. The diagnostic and prognostic value of amniotic fluid white blood cell count, glucose, interleukin-6, and gram stain in patients with preterm labor
and intact membranes. Am J Obstet Gynecol 1993;169:805–16.
61. King JF, Flenady VJ, Papatsonis DN, Dekker GA, Carbonne B. Calcium channel blockers for inhibiting preterm labour. Cochrane Database Syst Rev 2003;(1):CD002255.
62. Hutzal CE, Boyle EM, Kenyon SL, Nash JV, Winsor S, Taylor DJ et al. Use of antibiotics for the treatment of preterm parturition and prevention of neonatal morbidity: a metaanalysis. Am J Obstet Gynecol 2008;199:620. e1 – 8.
63. Vaisbuch E, Hassan SS, Mazaki-Tovi S, Nhan-Chang CL, Kusanovic JP, Chaiworapongsa T et al. Patients with an asymptomatic short cervix (<or=15 mm) have a high rate of subclinical intraamniotic inflammation: implications for patient counseling. Am J Obstet Gynecol 2010;202:433.e1–8.
Anexo 1. Cribado y prevención de parto prematuro en base a las evidencia de guía de parto prematuro
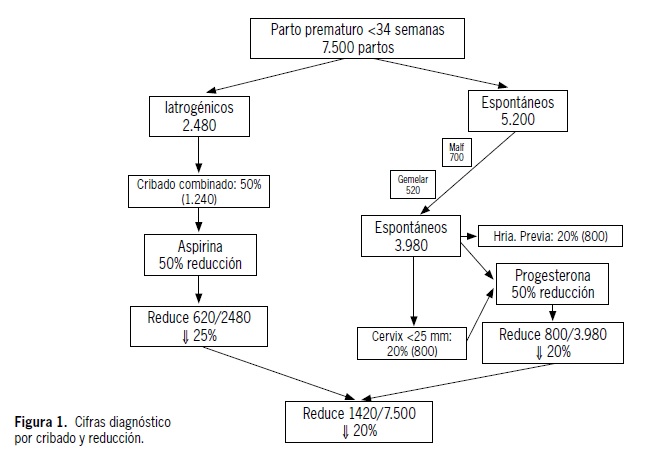
El impacto real de la aplicación de un esquema de cribado universal y prevención en base a la historia clínica y ecografía 20-25 semanas (sensibilidad 40%) para parto prematuro espontáneo, sería de 20% de la tasa de partos prematuros espontáneos. Por otro lado, el cribado de preeclampsia basado en historia clínica y Doppler arteria uterina a las 12 semanas (sensibilidad 50%), la introducción de aspirina desde esa semana de gestación podría reducir el riesgo de preeclampsia y RCF en 25%. Por lo tanto, en general, el riesgo de parto prematuro menor de 34 semanas se podría hipotéticamente reducir en 20%. Los esfuerzos siguen puestos en buscar mecanismos más efectivos de predicción y prevención de las causas que producen el síndrome de parto prematuro a las 12 semanas. En la figura 1 es posible observar las cifras reales de diagnóstico a través del cribado y reducción a través de la prevención en nuestro país.
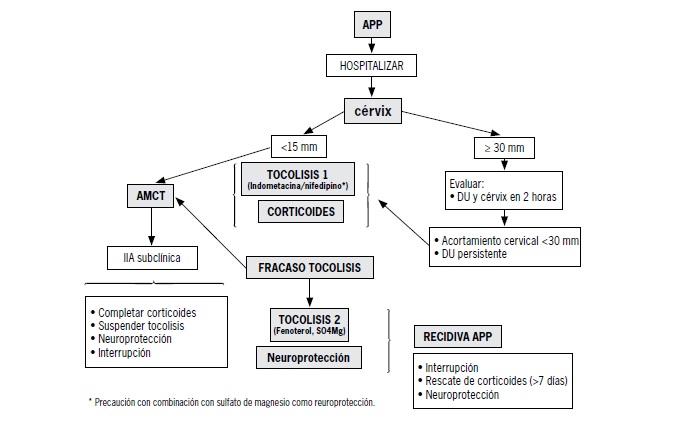
Anexo 2. Manejo parto prematuro menor a 34 semanas
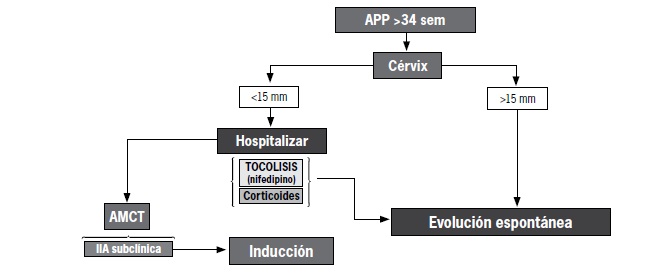
Anexo 3. Manejo de parto prematuro mayor a 34 semanas.
Correspondencia:
 Dr. Mauro Parra-Cordero
Dr. Mauro Parra-Cordero
 Departamento Obstetricia y Ginecología
Departamento Obstetricia y Ginecología
 [email protected]
[email protected]
 562 2978 8880 – 562 2978 8881
562 2978 8880 – 562 2978 8881