Abstracts Publicaciones 2021
Quiénes somos
Instrucciones a autores
Responsabilidad autoría
Contacto
Portal Revistas U. de Chile
¿Es el factor de crecimiento nervioso (NGF) un marcador útil durante el embarazo para la predicción de preeclampsia precoz?
Preeclampsia is one of the major causes of maternal and perinatal death, mainly in the severe early-onset presentation. Second trimester uterine artery Doppler has been demonstrated to be the most sensitive isolated predictive marker of early-onset preeclampsia. However, consistent evidence demonstrated that preventive therapies (aspirin or antioxidants) are not useful during mid-gestation. First trimester uterine artery Doppler has lower sensitivities for severe preeclampsia than second trimester measurement, but by performing a combined predictive model (uterine artery Doppler, biochemical angiogenic markers such as Placental Growth Factor, mean arterial blood pressure and maternal history) the sensitivity is significantly improved. Moreover, recent meta-analysis demonstrated that preventive therapies such as aspirin are useful only when begins before 16 weeks. The Nerve Growth Factor (NGF) is a member of the neurotrophin family with an important role in the development of cholinergic neurons. Recent studies demonstrated that NGF is a potent angiogenic factor in non-neurologic tissues. Patients with preeclampsia demonstrated decreased plasma levels of NGF immediately before delivery. The aim of this review is to evaluate the potential role of NGF as a biochemical marker of altered angiogenesis during pregnancy for prediction of early-onset preeclampsia.
Rev Hosp Clín Univ Chile 2014;25(2):135-42
Álvaro Sepúlveda-Martínez, Carmen Romero O., Margarita Vega I., Mauro Parra-Cordero
La preeclampsia (PE) es una enfermedad que afecta al 2-8% de la población, siendo una causa importante de morbimortalidad materna y perinatal(1). En Chile el último reporte oficial cataloga a la preeclampsia como la segunda causa de muerte materna, con un 26,8% del total de muertes(2). Debido a esto, el desarrollo de modelos predictivos de la forma precoz de la enfermedad se ha establecido como una estrategia útil para la implementación de potenciales tratamientos preventivos.
El objetivo de la presente revisión es evaluar la utilidad de la medición plasmática del factor de crecimiento nervioso como un marcador de angiogénesis alterada y su potencial uso como predictor de preeclampsia precoz.
PREECLAMPSIA
De acuerdo al Colegio Americano de Obstetras y Ginecólogos (ACOG por sus siglas en inglés), la PE se define como: presión arterial sistólica ≥ 140 mmHg y/o diastólica ≥ 90mmHg en al menos dos tomas con 6 horas de separación, asociado a proteinuria ≥ 300mg en 24 horas en paciente embarazada con edad gestacional de al menos 20 semanas y cifras tensionales normales previo al embarazo(3).
La PE de inicio temprano, definida como la que se presenta previo a las 34 semanas de gestación, se considera y acepta de mayor severidad que la PE de inicio tardía o después de las 34 semanas de gestación(4).
La PE severa (PES) compromete al 0,5% de las embarazadas(5) y es responsable de aproximadamente el 50% de las restricciones de crecimiento fetal (RCF) de origen placentario con tasas de mortalidad materna descrita de 0,2% en países desarrollados(6). Generalmente requiere interrupción antes de las 37 semanas, asociándose en un 80 a 90% con complicaciones neonatales si se presenta durante el segundo trimestre de gestación(6).
FISIOPATOLOGÍA DE LA PE
La PE es una enfermedad con múltiples mecanismos que contribuyen a su fisiopatología, siendo catalogada actualmente como un síndrome. Muchas hipótesis se han planteado con respecto a la etiología; sin embargo, una de la explicaciones más aceptadas es la placentación anómala y la disfunción endotelial secundaria a fenómenos de estrés oxidativo(7-10).
La alteración placentaria se expresa por una invasión deficiente del trofoblasto extravellositario (TEV) en la arteria espiralada. En consecuencia, se produce una hipoperfusión y/o ciclos de isquemia/ reperfusión, los que producen un estado de estrés oxidativo y como consecuencia de ello, aumenta las especies reactivas al oxígeno (ERO) en el espacio intervelloso. El estrés oxidativo placentario causado, entre otros, por moléculas de adhesión de citoquinas y quimoquinas, reclutan y activan leucocitos en el espacio intervelloso y causan daño en las células endoteliales. Las ERO aumentan la lipoperoxidación y peroxinitración(11), lo que reduce el óxido nítrico, la biodisponibilidad de las prostaciclinas, y produce oxidación de DNA. Todos estos cambios llevan al desarrollo de hipertensión, edema, proteinuria e hipercoagulabilidad.
Durante los últimos años se ha observado además una alteración en los niveles plasmáticos de proteínas angiogénicas y antiangiogénicas. Lam et al demostraron que los niveles de sFlt-1 (receptor soluble de VEGF) se encuentran aumentados en plasma de pacientes con preeclampsia incluso en períodos subclínicos(12), por tanto, el VEGF (factor de crecimiento vascular endotelial) plasmático se une a este receptor, disminuyendo su concentración plasmática e impidiendo de esta manera la acción angiogénica de VEGF en las células endoteliales.
En consecuencia, sFlt-1 es considerado un parámetro útil en predecir qué pacientes desarrollarán la forma severa de la enfermedad.
PREDICCIÓN DE PE
El desarrollo de diversos métodos de predicción de PE precoz ha permitido identificar a mujeres de alto riesgo que se benefician de un manejo más estricto. Dentro de éstos, el Doppler de arterias uterinas alterado en el segundo trimestre ha demostrado tasas de predicción de PE precoz cercanos a 85%(13), considerado actualmente el mejor parámetro aislado de predicción.
Diversos marcadores bioquímicos de estrés oxidativo, angiogénesis y anti-angiogénesis se han evaluado durante el primer(14–22) y segundo trimestre(23–29) para predicción de PE precoz y tardía, siendo el placental growth factor (PLGF) uno de los marcadores más evaluados y con resultados más consistentes en diversos estudios. Esto ha llevado al desarrollo de diversos modelos predictivos, utilizando el Doppler de arterias uterinas en el primer trimestre, combinado con la historia materna, que en población general presenta tasas de predicción de 43,8% a 89,2%(30-35), pero al incorporar a los modelos los marcadores bioquímicos, aumenta a 46,7 – 96,3% con 10% de falsos positivos(32–36) (Tabla 1).
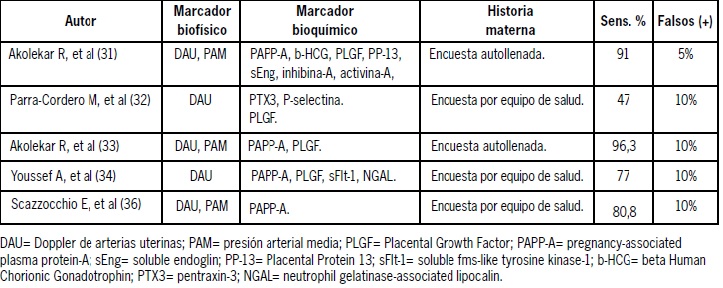
Tabla 1. Sensibilidad de los modelos predictivos de preeclampsia precoz durante el primer trimestre de embarazo.
ANGIOGÉNESIS
La angiogénesis (o neovascularización) corresponde a la formación de nuevos vasos a partir de vasos preformados. Cumple funciones importantes tanto en fenómenos fisiológicos (reparación de heridas) como patológicos (crecimiento tumoral). Para que este fenómeno sea llevado a cabo se requieren los siguientes pasos: degradación proteolítica de la membrana basal del vaso, migración de células endoteliales hacia la zona afectada (estímulo angiogénico), proliferación de células endoteliales, maduración de las células endoteliales (inhibición de crecimiento y remodelación tubular) y reclutamiento de las células periendoteliales (pericitos y fibras musculares lisas).
FACTOR DE CRECIMIENTO NERVIOSO
El factor de crecimiento nervioso (NGF por sus siglas en inglés) previamente conocido por ser una neurotrofina que participa en la sobrevida y diferenciación de las neuronas periféricas(37), se ha demostrado actualmente su presencia y participación en la regulación de diversos tejidos extra nerviosos (desarrollo folicular ovárico(38), páncreas(39) y timo(40). Otra acción importante del NGF es su acción angiogénica en diversos tejidos como la piel(41) y músculos esqueléticos(42), demostrándose su utilidad en estimular la reparación de heridas cutáneas tanto en condiciones fisiológicas como en condiciones patológicas como la diabetes(43).
Sus propiedades angiogénicas han despertado un gran interés por su implicancia en diversos procesos tanto fisiológicos como patológicos. Estudios in vitro tanto en humanos como en animales han demostrado que el NGF estimula la proliferación y sobrevida de células endoteliales en venas umbilicales humanas(44) y de células endoteliales de cerebro de rata(45), a través de la fosforilación de su receptor TRKA. Además, tanto en células de granulosa humana como en células epiteliales y endoteliales de cáncer ovárico, se ha encontrado la expresión de NGF y su receptor de alta afinidad TRKA(46-48). Adicionalmente, este grupo encontró que NGF es un factor angiogénico directo en células endoteliales e indirecto, porque NGF al activar a su receptor TRKA, induce la expresión de VEGF.
La vía de señalización de NGF en endotelio de aorta de cerdo fue demostrado a través de la activación de dos vías: Ras/ERK y P13K/Akt, las cuales son necesarias para estimular la migración celular, proceso clave en la angiogénesis(49). La activación de estas dos vías requiere la transducción de señal en coordinación con el VEGF; sin embargo, la inactivación del receptor de VEGF no ha demostrado impedir el fenómeno angiogénico, lo cual ratifica la función angiogénica del NGF a través de la fosforilación de su receptor específico TRKA(50).
Hasta la fecha sólo se ha publicado un estudio que evalúa los niveles plasmáticos de NGF en sangre materna y cordón del recién nacido en pacientes con preeclampsia(51). Kilari A et al evaluaron a 86 pacientes con preeclampsia y 105 controles (ambos de término) y determinaron las concentraciones plasmáticas maternas previo a la interrupción y en plasma de cordón umbilical inmediatamente posterior al parto. Demostraron que en pacientes con preeclampsia, los niveles plasmáticos de NGF son significativamente menores que en pacientes normotensas (257,6±122,85 pg/ml vs 316,3±109,7 pg/ml respectivamente). Esta diferencia fue aún mayor al comparar a pacientes con preeclampsia y recién nacido de bajo peso versus pacientes preeclámpticas con recién nacidos normopeso (209,5±110,2 pg/ml vs 287,5±121,7 pg/ml respectivamente). A pesar de estos resultados, no lograron demostrar diferencias significativas en muestras de cordón umbilical, tanto en pacientes con preeclampsia como en recién nacidos de bajo peso en comparación con los controles.
Estos resultados contrastan con una publicación que demuestra niveles significativamente menores de NGF en plasma materno y de recién nacidos afectados por restricción de crecimiento, en comparación con controles normopesos(52).
A pesar de estos hallazgos iniciales, no existen estudios que evalúen este marcador angiogénico en plasma de pacientes en el primer trimestre
como predictor de PE y la expresión de su receptor TRKA en placentas al parto de pacientes con PE y controles normotensas.
DISCUSIÓN
El enfrentamiento de la PE ha evolucionado de manera exponencial los últimos años. Un aspecto fundamental ha sido el desarrollo de diversos modelos predictivos durante el primer y segundo trimestre.
El aporte de Bujold et al(53-55) con respecto a la utilidad de la aspirina en reducir el riesgo de PE en un 50% y de PES y PE precoz en un 78% y 89% respectivamente, si ésta es iniciada antes de las 16 semanas de gestación, ha llevado a centrar la atención en los modelos predictivos de primer trimestre.
Nuestro grupo publicó recientemente que la predicción de PE precoz durante el primer trimestre, combinando el Doppler de arterias uterinas, antecedentes maternos y marcadores bioquímicos de angiogénesis placentaria, conlleva una predicción moderada de un 47% con una tasa de falsos (+) de 10%(32); por lo que el identificar nuevos potenciales marcadores que incrementen la predicción traerá como consecuencia una mejora de nuestro modelo, pudiendo en un futuro implementarse en la práctica clínica habitual.
El NGF a pesar de no haber sido estudiado hasta la fecha en el primer trimestre del embarazo, Kilari A et al demostraron valores plasmáticos significativamente menores tanto en pacientes con PE establecida como pacientes con restricción de crecimiento asociado a preeclampsia(51), por lo que se visualiza como un potencial marcador precoz de angiogénesis deficiente. Los marcadores angiogénicos han demostrado ser los más consistentes marcadores precoces de PE, ya que basado en los modelos publicados que incorporan marcadores bioquímicos de angiogénesis, disfunción endotelial y estrés oxidativo, el PLGF (marcador angiogénico por excelencia) ha sido el que ha demostrado mejores resultados durante el primer trimestre en diversas poblaciones.
Se requieren estudios prospectivos que evalúen la utilidad del NGF como un marcador precoz de PE precoz y posteriormente validar su utilidad en poblaciones diferentes para de esta manera evaluar su potencial aplicabilidad clínica.
REFERENCIAS
1. Steegers E, von Dadelszen P, Duvekot J, Pijnenborg R. Pre-eclampsia. Lancet 2010;376:631–44.
2. Editorial. Tras el cumplimiento del 5º objetivo del milenio: mortalidad materna, Chile 2008. Rev Chil Obstet Ginecol 2011;76:1–2.
3. ACOG Practice Bulletin. Diagnosis and management of preeclampsia and eclampsia. Obstet Gynecol 2002;99:159–67.
4. Kucukgoz Gulec U, Tuncay Ozgunen F, Buyukkurt S, Baris Guzel A, Ferhat Urunsak I, Cansun Demir S, et al. Comparison of clinical and laboratory findings in early- and lateonset preeclampsia. J Matern Fetal Neonatal Med. 2013 Feb 18. [Epub ahead of print]
5. The management of severe pre-eclampsia/eclampsia. RCOG Guideline 2006; No. 10(A).
6. Ghulmiyyah L, Sibai BM. Chapter 35: Gestational Hypertension, Preeclampsia, and Eclampsia. In Quennan´s Management of High-Risk Pregnancy. An Evidence-Based Approach, Quennan J, Spong C, Lockwood C (eds). Willey-Blackwell 6th Edition 2012:280-8.
7. Roberts JM, Lain KY. Recent insights into the pathogenesis of pre-eclampsia. Placenta 2002;23:359–72.
8. Redman CW, Sargent IL. Placental stress and pre-eclampsia: a revised view. Placenta 2009;30 (Suppl A): S38 - S42.
9. Bernardi F, Guolo F, Bortolin T, Petronilho F, Dal-Pizzol F. Oxidative stress and inflammatory markers in normal pregnancy and preeclampsia. J Obstet Gynaecol Res 2008;34:948–51.
10. Schiessl B. Inflammatory response in preeclampsia. Mol Aspects Med 2007;28:210.
11. Bosco C, González J, Gutiérrez R, Parra-Cordero M, Barja P, Rodrigo R. Oxidative damage to pre-eclamptic placenta: immunohistochemical expression of VEGF, nitrotyrosine residues and von Willebrand factor. J Matern Fetal Neonatal Med 2012;25:2339–45.
12. Lam C, Lim K, Karumanchi A. Circulating angiogenic factors in the pathogenesis and prediction of preeclampsia. Hypertension 2005;46:1077–85.
13. Parra M, Rodrigo R, Barja P, Bosco C, Fernández V, Muñoz H, et al. AM J Obstet Gynecol 2005;193:1486–91.
14. Chafetz I, Kuhnreich I, Sammar M, Tal Y, Gibor Y, Meiri H, et al. First-trimester placental protein 13 screening for preeclampsia and intrauterine growth restriction. Am J Obstet Gynecol 2007;197:35.e1-35.e7.
15. Di Lorenzo G, Ceccarello M, Cecotti V, Ronfani L, Monasta L, Vecchi Brumatti L, et al. First trimester maternal serum PIGF, free b-hCG, PAPP-A, PP-13, uterine artery Doppler and maternal history for the prediction of preeclampsia. Placenta 2012;33:495–501.
16. Foidart JM, Munaut C, Chantraine F, Akolekar R, Nicolaides KH. Maternal plasma soluble endoglin at 11–13 weeks’ gestation in pre-eclampsia. Ultrasound Obstet Gynecol 2010;35:680–7.
17. Akolekar R, de Cruz J, Foidart J, Munaut C, KH Nicolaides. Maternal plasma soluble fms-like tyrosine kinase-1 and free vascular endothelial growth factor at 11 to 13 weeks of gestation in preeclampsia. Prenat Diagn 2010;30:191–7.
18. Nicolaides KH, Bindra R, Turan OM, Chefetz I, Sammar M, Meiri H, et al. A novel approach to first-trimester screening for early preeclampsia combining serum PP-13 and Doppler ultrasound. Ultrasound Obstet Gynecol 2006;27:13–7.
19. Baumann MU, Bersinger NA, Mohaupt MG, Raio L, Gerber S, Surbek D. First-trimester serum levels of soluble endoglin and soluble fms-like tyrosine kinase-1 as first-trimester markers for late-onset preeclampsia. Am J Obstet Gynecol 2008;199:266.e1 – 266.e6.
20 Poon L, Maiz N, Valencia C, Plasencia W, Nicolaides KH. First-trimester maternal serum pregnancy-associated plasma protein-A and pre-eclampsia. Ultrasound Obstet Gynecol 2009;33:23–33.
21 Romero R, Nien JK, Espinoza J, Todem D, Fu W, Chung H, et al. A longitudinal study of angiogenic (placental growth factor) and anti-angiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor-1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate. J Matern Fetal Neonatal Med 2008;21:9–23.
22 Erez O, Romero R, Espinoza J, Fu W, Todem D, Kusanovic JP. The change in concentrations of angiogenic and anti-angiogenic factors in maternal plasma between the first and second trimesters in risk assessment for the subsequent development of preeclampsia and small-for-gestational age. J Matern Fetal Neonatal Med 2008;21:279–87.
23. Levine R, Maynard S, Qian C, Lim K, England L, Yu K, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med 2004;350:672–83.
24. Levine R, Lam C, Qian C, Yu K, Maynard S, Sachs B, et al. Soluble endoglin and other circulating antiangiogenic factors in preeclampsia. N Engl J Med 2006;355:992–1005.
25. De Vivo A, Baviera G, Giordano D, Todarello G, Corrado F, D’anna R. Endoglin, PlGF and sFlt-1 as markers for predicting pre-eclampsia. Acta Obstet Gynecol Scand.2008;87:837–42.
26. Stepan H, Geipel A, Schwarz F, Krämer T, Wessel N, Faber R. Circulatory soluble endoglin and its predictive value for preeclampsia in second-trimester pregnancies with abnormal uterine perfusion. Am J Obstet Gynecol 2008;198:175.e1 – 175.e6.
27. Kleinrouweler C, Wiegerinck M, Ris-Stalpers C, Bossuyt P, van der Post J, von Dadelszen P, et al. Accuracy of circulating placental growth
factor, vascular endothelial growth factor, soluble fms-like tyrosine kinase 1 and soluble endoglin in the prediction of pre-eclampsia: a systematic review and meta-analysis. BJOG 2012;119:778-87.
28. Plasencia W, Maiz N, Bonino S, Kaihura C, Nicolaides KH. Uterine artery Doppler at 11 + 0 to 13 + 6 weeks in the prediction of pre-eclampsia. Ultrasound Obstet Gynecol 2007;30:742–9.
29. Poon L, Staboulidou I, Maiz N, Plasencia W, Nicolaides KH. Hypertensive disorders in pregnancy: screening by uterine artery Doppler at 11–13 weeks. Ultrasound Obstet Gynecol 2009;34:142–8.
30. Poon L, Karagiannis G, Leal A, Romero X, Nicolaides KH. Hypertensive disorders in pregnancy: screening by uterine artery Doppler imaging and blood pressure at 11–13 weeks. Ultrasound Obstet Gynecol 2009;34:497–502.
31. Akolekar R, Syngelaki A, Sarquis R, Zvanca M, Nicolaides KH. Prediction of early, intermediate and late preeclampsia from maternal factors, biophysical and biochemical markers at 11–13 weeks. Prenat Diagn 2011;31:66–74.
32. Parra-Cordero M, Rodrigo R, Barja P, Bosco C, Rencoret G, Sepúlveda-Martinez A, et al. Prediction of early and late preeclampsia from maternal characteristics, uterine artery Doppler and markers of vasculogenesis during the first trimester of pregnancy. Ultrasound Obstet Gynecol 2013;41:538–44.
33. Akolekar R, Syngelaki A, Poon L, Wright D, Nicolaides KH. Competing risks model in early screening for preeclampsia by biophysical and biochemical markers. Fetal Diagn Ther 2013;33:8–15.
34. Youssef A, Righetti F, Morano D, Rizzo N, Farina A. Uterine artery Doppler and biochemical markers (PAPP-A, PlGF, sFlt-1, P-selectin, NGAL) at 11 + 0 to 13 + 6 weeks in the prediction of late (>34 weeks) pre-eclampsia. Prenat Diagn 2011;31:1141–6.
35. Crispi F, Llurba E, Domínguez C, Martín-Gallán P, Cabero L, Gratacós E. Predictive value of angiogenic factors and uterine artery Doppler for early- versus late-onset preeclampsia and intrauterine growth restriction. Ultrasound Obstet Gynecol 2008;31:303–9.
36. Scazzocchio E, Figueras F, Crispi F, Meler E, Masoller N, Mula R, et al. Performance of a first-trimester screening of preeclampsia in a routine care low-risk setting. Am J Obstet Gynecol 2013; 208: 203.e1 – 203.e10.
37. Vera C, Tapia V, Kohan K, Gabler F, Ferreira A, Selman A, et al. Nerve growth factor induces the expression of chaperone protein calreticulin in human epithelial ovarian cells. Horm Metab Res 2012;44:639–43.
38. Dissen GA, Romero C, Hirshfield AN, Ojeda SR. Nerve growth factor is required for early follicular development in the mammalian ovary. Endocrinology 2001;142:2078–86.
39. Sharfmann R, Tazi A, Polak M, Kanaka C, Czernichow P. Expression of functional nerve growth factor receptors in pancreatic β-cell lines and fetal rat islets in primary culture. Diabetes 1993;42:1829–36.
40. García-Suárez O, Germanà A, Hannestad J, Ciriaco E, Laurà R, Naves J, et al. TrkA is necessary for the normal development of the murine thymus. J Neuroimmunol 2000;108:11–21.
41. Chiaretti A, Piastra M, Caresta E, Nanni L, Aloe L. Improving ischaemic skin revascularisation by nerve growth factor in a child with crush syndrome. Arch Dis Child 2002;87:446–8.
42. Emanueli C, Salis MB, Pinna A, Graiani G, Manni L, Madeddu P. Nerve growth factor promotes angiogenesis and arteriogenesis in ischemic hindlimbs. Circulation 2002;106:2257–62.
43. Graiani G, Emanueli C, Desortes E, Van Linthout S, Pinna A, Figueroa C, et al. Nerve growth factor promotes reparative angiogenesis and inhibits endothelial apoptosis in cutaneous wounds of Type 1 diabetic mice. Diabetologia 2004;47:1047–54.
44. Cantarella G, Lempereur L, Presta M, Ribatti D, Lombardo G, Lazarovici P, et al. Nerve growth factor-endothelial cell interaction leads to angiogenesis in vitro and in vivo. FASEB J 2002;16:1307–9.
45. Moser KV, Reindl M, Blasig I, Humpel C. Brain capillary endothelial cells proliferate in response to NGF, express NGF receptors and secrete NGF after inflammation. Brain Res 2004;1017:53–60.
46. Julio-Pieper M, Lozada P, Tapia V, Vega M, Miranda C, Vantman D, et al. Nerve Growth factor induces vascular endothelial growth factor expression in granulosa cells via a trkA receptor/mitogen-activated protein kinase-extracellularly regulated Kinase 2-dependent pathway. J Clin Endocrinol Metab 2009:94:3065–71.
47. Campos X, Muñoz Y, Selman A, Yazigi R, Moyano L, Weinstein-Oppenheimer C, et al. Nerve growth factor and its high-affinity receptor trkA participate in the control of vascular endothelial growth factor expression in epithelial ovarian cancer. Gynecologic Oncology 2007;104:168–75.
48. Tapia V, Gabler F, Muñoz M, Yazigi R, Paredes A, Selman A, et al. Tyrosine kinase A receptor (trkA): A potential marker in epithelial ovarian cancer. Gynecologic Oncology 2011;121:13–23.
49. Rahbek UL, Dissing S, Thomassen C, Hansen AJ, Tritsaris K. Nerve growth factor activates aorta endothelial cells causing Pl3K/Akt- and ERK-dependent migration. Pflugers Arch Eur J Physiol 2005;450:355–61.
50. Nico B, Mangieri D, Benagiano V, Crivellato E, Ribatti D. Nerve growth factor as an angiogenic factor. Microvasc Res 2008;75:135–41.
51. Kilari A, Mehendale S, Pisal H, Panchanadikar T, Kale A, Joshi S. Nerve growth factor, birth outcome and pre-eclampsia. Int J Devl Neuroscience 2011;29:71–5.
52. Malamitsi-Puchner A1, Nikolaou KE, Economou E, Boutsikou M, Boutsikou T, Kyriakakou M, et al. Intrauterine growth restriction and circulating neurotrophin levels at term. Early Hum Dev. 2007;83:465–9.
53. Bujold E, Roberge S, Lacasse Y, Bureau M, Audibert F, Marcoux S, et al. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol 2010;116(2 Pt 1):402–414.
54. Roberge S, Giguère Y, Villa P, Nicolaides K, Vainio M, Forest JC, et al. Early Administration of low-dose aspirin for the prevention of severe and mild preeclampsia: a systematic review and meta- analysis. Am J Perinatol 2012;29:551–6.
55. Roberge S, Villa P, Nicolaides K, Giguère Y, Vainio M, Bakthi A, et al. Early Administration of Low-Dose Aspirin for the Prevention of Preterm and Term Preeclampsia: A Systematic Review and Meta-Analysis. Fetal Diagn Ther 2012;31:141–6.
Correspondencia:
 Dr. Mauro Parra-Cordero
Dr. Mauro Parra-Cordero
 Departamento de Obstetricia y Ginecología
Departamento de Obstetricia y Ginecología
 [email protected]
[email protected]
 562 2978 8881 / 562 2978 8880
562 2978 8881 / 562 2978 8880